Diferencia entre el orbital 1S y 2S

Diferencia de clave: 1S vs 2s Orbital
Atom es la unidad de materia más pequeña. En otras palabras, toda la materia está hecha de átomos. Un átomo está compuesto por partículas subatómicas, principalmente, protones, electrones y neutrones. Protones y electrones hacen el núcleo, que se encuentra en el centro del átomo. Pero los electrones se colocan en orbitales (o niveles de energía) que se encuentran fuera del núcleo de un átomo. También es importante tener en cuenta que los orbitales son conceptos hipotéticos que se utilizan para explicar la ubicación más probable de un átomo. Hay varios orbitales que rodean el núcleo. También hay suborbitales como S, P, D, F, etc. El suborbital S es de forma esférica cuando se considera una estructura 3D. El orbital S tiene la mayor probabilidad de encontrar un electrón alrededor del núcleo. Un suborbital vuelve a numerarse como 1S, 2S, 3S, etc. Según los niveles de energía. La diferencia clave entre el orbital 1S y 2S es la energía de cada orbital. El orbital de 1s tiene una energía más baja que el orbital 2S.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el orbital de 1S?
3. ¿Qué es 2s orbital?
4. Comparación de lado a lado - 1S vs 2s Orbital
5. Resumen
¿Qué es el orbital de 1S??
1s orbital es el orbital más cercano al núcleo. Tiene la energía más baja entre otros orbitales. También es la forma esférica más pequeña. Por lo tanto, el radio de S orbital es pequeño. Solo puede haber 2 electrones en el orbital S. La configuración de electrones se puede escribir como 1s1, Si solo hay un electrón en el orbital S. Pero si hay un par de electrones, se puede escribir como 1S2. Luego, los dos electrones en el orbital S se mueven a las direcciones opuestas debido a la repulsión que ocurre debido a las mismas cargas eléctricas de los dos electrones. Cuando hay un electrón no apartado, se llama paramagnético. Eso es porque puede ser atraído por un imán. Pero si el orbital se llena y un par de electrones están presentes, los electrones no pueden ser atraídos por un imán; Esto se conoce como diamagnético.
¿Qué es 2s orbital??
El orbital 2s es mayor que 1s orbital. Por lo tanto, su radio es mayor que el del orbital de 1. Es el próximo armario orbital para el núcleo después de 1s orbital. Su energía es mayor que 1S orbital pero es más baja que otros orbitales en un átomo. 2s orbital también se puede llenar solo con uno o dos electrones. Pero el orbital 2s está lleno de electrones solo después de la finalización del orbital de 1. Esto se llama Principio de Aufbau, que indica el orden del llenado de electrones en suborbitales.
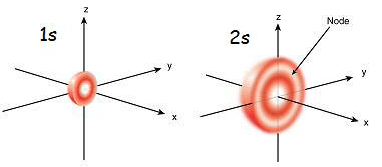
Figura 01: orbital 1S y 2S
¿Cuál es la diferencia entre el orbital 1S y 2S??
1s vs 2s orbital | |
| El orbital de 1s es el orbital más cercano al núcleo. | 2s orbital es el segundo orbital más cercano para el núcleo. |
| Nivel de energía | |
| La energía del orbital de 1s es menor que la del orbital 2s. | 2s tiene energía relativamente mayor. |
| Radio de orbital | |
| El radio de 1s orbital es más pequeño. | El radio del orbital 2s es relativamente grande. |
| Tamaño del orbital | |
| El orbital 1 tiene la forma esférica más pequeña. | 2s Orbital es mayor que el orbital 1S. |
| Relleno de electrones | |
| Los electrones se llenan primero en el orbital de 1S. | 2s Orbital se llena solo después de la finalización de los electrones en el Orbital de 1S. |
Resumen -1S vs 2s Orbital
Un átomo es una estructura 3D que contiene un núcleo en el centro rodeado de orbitales de forma de diversas de diferentes niveles de energía. Estos orbitales se dividen nuevamente en suborbitales de acuerdo con ligeras diferencias de energía. Electrones, que es una partícula subatómica importante de un átomo se encuentra en estos niveles de energía. Los suborbitales 1S y 2S son más cercanos al núcleo. La principal diferencia entre los orbitales 1S y 2S es la diferencia de su nivel de energía, que es, 2s Orbital es un nivel de energía más alto que el orbital de 1S.
Referencia:
1. Bibliotecas. "Orbitales atómicos."Bibliotecas de química. Libretexts, 03 de noviembre. 2015. Web. 26 de mayo de 2017. .
2. Átomos, electrones y orbitales. norte.pag., norte.d. Web. 26 de mayo de 2017. .
Imagen de cortesía:
1. "S Orbitals" (recortado) por la Fundación CK -12 - Archivo: Química de la escuela secundaria.PDF, página 265 (CC BY-SA 3.0) a través de Commons Wikimedia


