Diferencia entre acetaldehído y acetona
Diferencia clave: acetaldehído vs acetona
Tanto el acetaldehído como la acetona son moléculas orgánicas pequeñas, pero hay una diferencia entre ellas basadas en sus grupos funcionales. En otras palabras, son dos compuestos de carbonilo diferentes con diferentes propiedades químicas y físicas. La acetona es el miembro más pequeño del grupo cetonos, mientras que el acetaldehído es el miembro más pequeño del grupo aldehído. El diferencia clave entre acetaldehído y acetona está el número de átomos de carbono en la estructura; acetona tiene tres Átomos de carbón, pero acetaldehído Sólo tiene dos Átomos de carbón. La diferencia en el número de átomos de carbono y tener dos grupos funcionales diferentes conduce a muchas otras diferencias en sus propiedades.
Que es acetona?
Acetone es el miembro más pequeño de Ketone Group, también conocido como propanona. Es un líquido incoloro, volátil y inflamable que se usa como solvente. La mayoría de los solventes orgánicos no se disuelven en agua, pero la acetona es miscible con agua. Muy a menudo se usa para fines de limpieza en el laboratorio y como el ingrediente activo principal en los líquidos del removedor de esmalte y en la pintura delgada. 
¿Qué es el acetaldehído??
Acetaldehído, también conocido como etanal es el miembro más pequeño de Aldehyde Group. Es un líquido incoloro e inflamable con un fuerte olor a sofocos. Hay muchos usos industriales, como producir ácido acético, perfumes, drogas y algunos sabores.
¿Cuál es la diferencia entre acetaldehído y acetona??
Estructura y propiedades generales de acetaldehído y acetona
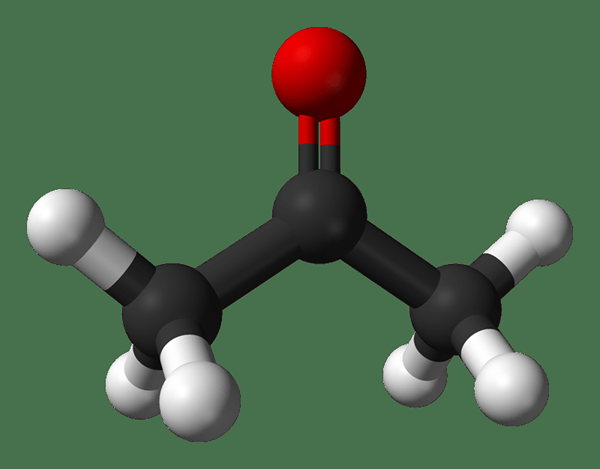
Acetona: La fórmula molecular de acetona c3H6O. Es el miembro más simple de la familia de cetones. Es un líquido volátil y inflamable con un olor picante.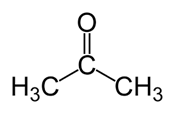
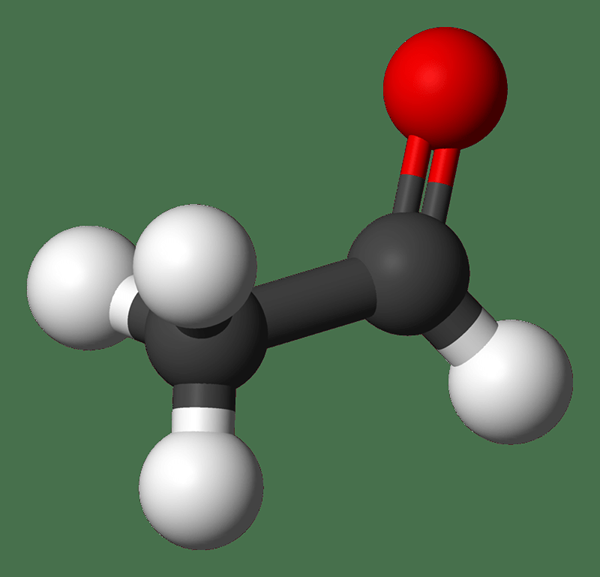
Acetaldehído: La fórmula molecular del acetaldehído C2H4O. Es el más simple y uno de los miembros más importantes de la familia Aldehyde. Es un líquido incoloro, volátil y inflamable a la temperatura ambiente.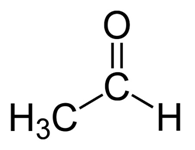
Ocurrencia de acetaldehído y acetona
Acetona: En general, la acetona está presente en la sangre humana y la orina. También se genera y dispuesta en el cuerpo humano durante el metabolismo normal. Cuando las personas tienen diabéticos, se produce en grandes cantidades en el cuerpo humano.
Acetaldehído: El acetaldehído se encuentra naturalmente en varias plantas (café), pan, verduras y frutas maduras. Además, se encuentra en el humo de cigarrillo, la gasolina y el escape diesel. Además, es un intermedio en el metabolismo del alcohol.
Usos de acetaldehído y acetona
Acetona: La acetona se usa principalmente como solvente orgánico en los Laboratorios Químicos y también es el agente activo en la producción de removedor de esmalte y más delgado en la industria de la pintura.
Acetaldehído: La acetona se usa para fabricar ácido acético, perfumes, tintes, agentes y drogas saborizantes.
Características de acetaldehído y acetona
Identificación
Acetona: La acetona da un resultado positivo para la prueba de yodoformo. Por lo tanto, se puede diferenciar fácilmente del acetaldehído utilizando la prueba de yodoformo.
Acetaldehído: Acetaldehído da un espejo plateado al "Reactivo de Tollen" mientras que las cetonas no dan un resultado positivo para esta prueba. Porque no se puede oxidar fácilmente. La prueba de ácido crómico y el reactivo de Fehling también se pueden usar para identificar el acetaldehído.
Reactividad
La reactividad de los grupos carbonilo (aldehídos y cetonas) se debe principalmente al grupo carbonilo (C = O).
Acetona: En general, los grupos alquilo son grupos de donación de electrones. La acetona tiene dos grupos metilo y disminuye la polarización del grupo carbonilo. Por lo tanto, hace que el compuesto sea menos reactivo. Dos grupos metilo unidos a ambos lados del grupo carbonilo conducen a un obstáculo más esteárico también. Por lo tanto, la acetona es menos reactiva que el acetaldehído.
Acetaldehído: En contraste, el acetaldehído tiene solo un grupo metilo y un átomo de hidrógeno unido al grupo carbonilo. A medida que el grupo metilo dona electrones, el átomo de hidrógeno retira electrones; Esto hace que la molécula sea más polarizada, y hace que la molécula sea más reactiva. En comparación con la acetona, el acetaldehído tiene menos efectos estáricos, y otras moléculas pueden acercarse fácilmente. Debido a estas razones, el acetaldehído es más reactivo que la acetona.


