Diferencia entre ácido acético y acetato
Diferencia clave: ácido acético vs acetato
La diferencia clave entre el ácido acético y el acetato es que El ácido acético es un compuesto neutro, mientras que el acetato es un anión que tiene una carga eléctrica negativa neta.
El ácido acético es un compuesto orgánico que ayuda a fabricar vinagre, mientras que el ion acetato es la base conjugada del ácido acético. Lo más importante es que la formación del ion acetato ocurre mediante la eliminación del átomo de hidrógeno en el grupo carboxílico del ácido acético.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el ácido acético?
3. Que es acetato
4. Comparación lado a lado: ácido acético frente a acetato en forma tabular
5. Resumen
¿Qué es el ácido acético??
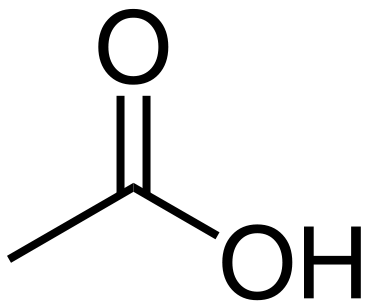
El ácido acético es un compuesto orgánico que tiene la fórmula química Pez3Cooh. La masa molar de este compuesto es de 60 g/mol, mientras que el nombre IUPAC de este compuesto es Ácido etanoico. Además, a temperatura ambiente, el ácido acético es un líquido incoloro con un sabor agrio. El ácido acético se clasifica como un ácido carboxílico como resultado de la presencia de un grupo de ácido carboxílico (-COOH).

Figura 1: molécula de ácido acético
El ácido acético glacial es la forma concentrada de ácido acético. Además, el ácido acético tiene un olor picante, que es similar al olor del vinagre y un sabor agrio característico también. También es un ácido débil porque se disocia parcialmente en solución acuosa, liberando anión acetato y un protón. El ácido acético tiene un protón disociable por molécula. Sin embargo, el ácido glacial es un irritante que es altamente corrosivo.
El ácido acético es un simple ácido carboxílico; De hecho, es el segundo ácido carboxílico más simple. En el estado sólido del ácido acético, las moléculas forman cadenas de moléculas a través del enlace de hidrógeno. Sin embargo, en la fase de vapor del ácido acético, forma dímeros (dos moléculas conectadas entre sí a través de enlaces de hidrógeno). Dado que el ácido acético líquido es un disolvente apópico polar, es miscible con muchos solventes polares y no polares.
Que es acetato?
El acetato es un anión formado por la eliminación de un átomo de hidrógeno del ácido acético. Este anión tiene una carga negativa neta (la carga es -1 como resultado de la liberación de un protón). Acetato no se puede permanecer como un compuesto individual debido a su carga, que es altamente reactiva. Por lo tanto, existe principalmente como una sal de un metal álcali. El ion acetato es la base conjugada del ácido acético, que en consecuencia se forma a partir de la disociación del ácido acético.
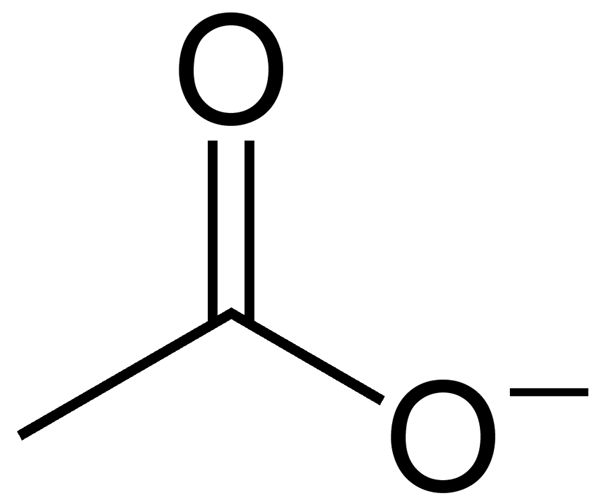
Figura 2: Anión acetato
La fórmula química de este anión es C2H3O2- mientras Su nombre IUPAC es etanoato. Además, la masa molar de acetato es de 59 g/mol. Específicamente, a valores de pH superiores a 5.5, el ácido acético existe como anión acetato, liberando un protón espontáneamente. Esto se debe a que, a alto pH, el ion acetato es estable que el ácido acético.
¿Cuál es la diferencia entre ácido acético y acetato??
Ácido acético vs acetato | |
| El ácido acético es un compuesto orgánico que tiene la fórmula química3Cooh. | El acetato es un anión formado por la eliminación de un átomo de hidrógeno del ácido acético. |
| Masa molar | |
| La masa molar de ácido acético es de 60 g/mol. | Pero la masa molar de acetato es de 59 g/mol. |
| Carga eléctrica | |
| El ácido acético no tiene carga neta. | Acetato tiene una carga negativa. |
| Categoría | |
| El ácido acético es una molécula orgánica. | El acetato es un anión orgánico. |
| ph | |
| Las moléculas de ácido acético son estables con un valor de pH bajo (alrededor del pH 5). | El ion acetato es estable a altos valores de pH (más alto que el pH 5.5). |
Resumen -ácido acético vs acetato
El ácido acético es el segundo ácido carboxílico más simple. El acetato, por otro lado, es un anión derivado del ácido acético. La diferencia clave entre el ácido acético y el acetato es que el ácido acético es un compuesto neutro, mientras que el acetato es un anión que tiene una carga eléctrica negativa neta.
Referencia:
1. "Ácido acético."Wikipedia, 18 de abril. 2018, disponible aquí.
2. "Ácido acético."Centro Nacional de Información de Biotecnología. Base de datos de compuestos de pubChem, u.S. Biblioteca Nacional de Medicina, disponible aquí.
3. "Acetato."Wikipedia, 10 de abril. 2018, disponible aquí.
Imagen de cortesía:
1. "Acetic-ácido-2D-esquelético" (dominio público) a través de Commons Wikimedia
2. "Acetato-anion-canónico-formal-2D-esquelético" (dominio público) a través de Commons Wikimedia


