Diferencia entre acetona y alcohol isopropílico
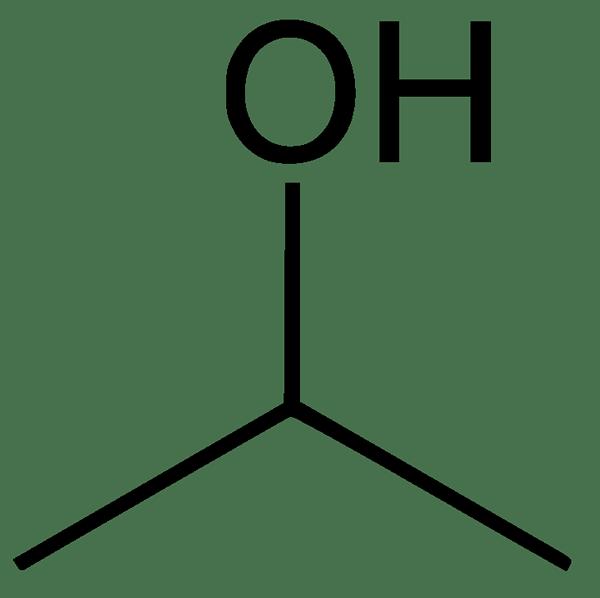
El diferencia clave entre acetona y alcohol isopropílico es que La acetona tiene un enlace C = O en el medio de la estructura química, mientras que el alcohol isopropílico tiene un grupo C-OH en el medio de la estructura química.
La acetona y el alcohol isopropílico tienen estructuras muy similares; Ambos compuestos tienen tres átomos de carbono por molécula, y hay sustituciones en el carbono medio. El grupo sustituido en el carbono medio es diferente entre sí; La acetona tiene un grupo oxo, mientras que el alcohol isopropílico tiene un grupo hidroxilo.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es acetona
3. ¿Qué es el alcohol isopropílico?
4. Comparación de lado a lado - Acetona vs alcohol isopropílico en forma tabular
5. Resumen
Que es acetona?
La acetona es un compuesto orgánico que tiene la fórmula química (CH3)2CO. Esta sustancia aparece como un líquido incoloro e inflamable que es muy volátil. La acetona es el compuesto más simple y más pequeño entre las cetonas. La masa molar es de 58 g/mol. Este compuesto tiene un olor picante e irritante y es miscible con agua. La acetona es común como solvente polar. La polaridad se produce debido a la alta diferencia de electronegatividad entre los átomos de carbono y oxígeno del grupo carbonilo. Sin embargo, no es tan altamente polar; Por lo tanto, la acetona puede disolver sustancias lipofílicas e hidrofílicas.
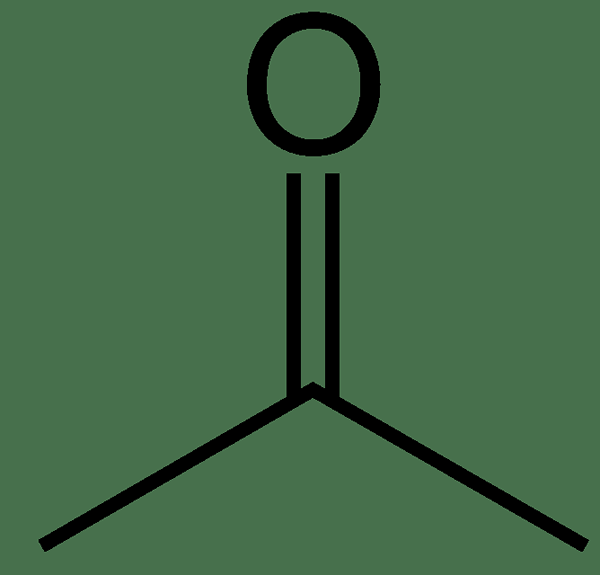
Figura 01: Estructura química de la acetona
Nuestro cuerpo puede producir acetona en procesos metabólicos normales, y se elimina del cuerpo a través de diferentes mecanismos. En la escala industrial, el método de producción incluye producción directa o indirecta de propileno. El proceso común es el proceso cumeno.
¿Qué es el alcohol isopropílico??
El alcohol isopropílico o el 2-propanol es un alcohol que tiene la fórmula molecular C3H8O. Este compuesto tiene la misma fórmula molecular que el propanol. El peso molecular es de alrededor de 60 g de moles-1. Por lo tanto, podemos decir que el alcohol isopropílico es un isómero de propanol. Hay un grupo hidroxilo en esta molécula que está unido al segundo átomo de carbono en la cadena de carbono. Este apego lo convierte en un alcohol secundario. Por lo tanto, sufre todas las reacciones típicas de un alcohol secundario.
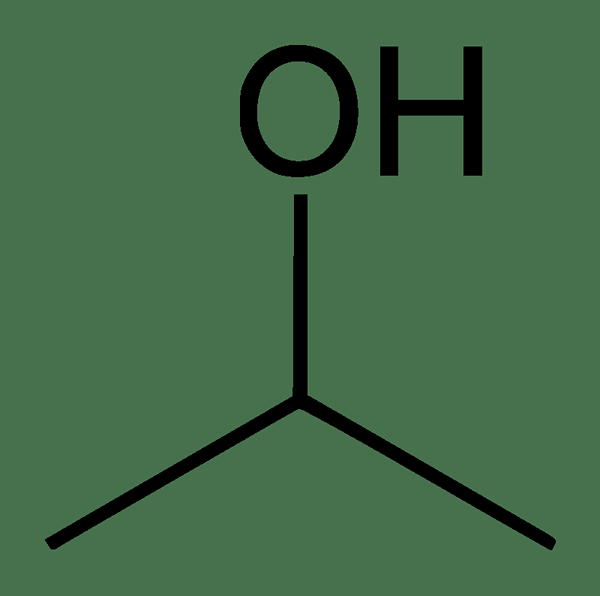
Figura 02: Estructura química del alcohol isopropílico
Además, el punto de fusión del alcohol isopropílico es -88OC, mientras que el punto de ebullición es 83OC. Este líquido es miscible con agua y es estable en condiciones normales. El alcohol isopropílico es un líquido incoloro, claro y inflamable. Además, se oxida violentamente para producir acetona. Al considerar las aplicaciones de este alcohol, es útil como solvente y se usa en productos farmacéuticos, productos para el hogar y productos de cuidado personal. También podemos usarlo para hacer otros productos químicos.
¿Cuál es la diferencia entre acetona y alcohol isopropílico??
La acetona y el alcohol isopropílico tienen estructuras muy similares; Ambos compuestos tienen tres átomos de carbono por molécula, y hay sustituciones en el carbono medio. La diferencia clave entre la acetona y el alcohol isopropílico es que la acetona tiene un enlace C = O en el medio de la estructura química, mientras que el alcohol isopropílico tiene un grupo C-OH en el medio de la estructura química.
La siguiente infografía enumera las principales diferencias entre la acetona y el alcohol isopropílico en forma tabular para la comparación de lado a lado.
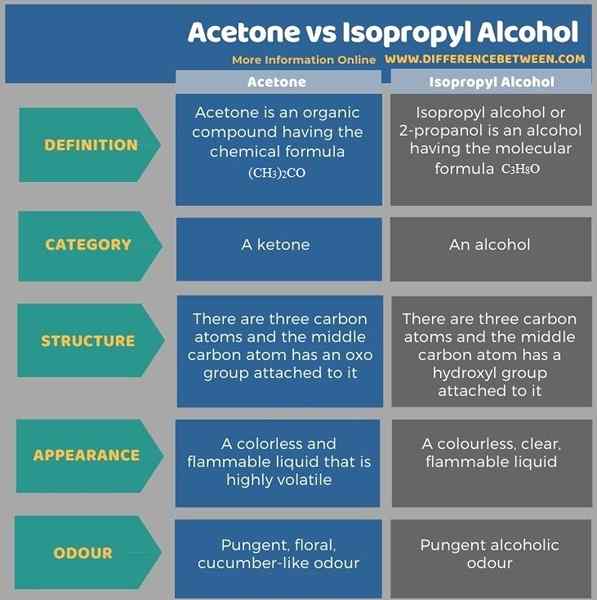
Resumen -Acetona vs alcohol isopropílico
Los grupos sustituidos en el carbono medio de la acetona y el alcohol isopropílico son diferentes entre sí; La acetona tiene un grupo oxo, mientras que el alcohol isopropílico tiene un grupo hidroxilo. La diferencia clave entre la acetona y el alcohol isopropílico es que la acetona tiene un enlace C = O en el medio de la estructura química, mientras que el alcohol isopropílico tiene un grupo C-OH en el medio de la estructura química.
Referencia:
1. Helmenstine, Anne Marie. "La composición química del alcohol frotando."Thinkco, agosto. 27, 2020, disponible aquí.
Imagen de cortesía:
1. "Acetone-2D-esquelético" de Fvasconcellos-Versión vectorial del archivo: Acetone-2D-esquelético.PNG por Ben Mills (dominio público) a través de Commons Wikimedia
2. "2 -propanol" de Yikrazuul - Trabajo propio (dominio público) a través de Commons Wikimedia


