Diferencia entre ácido y base
La diferencia clave entre el ácido y la base es que Los ácidos tienen valores de pH que varían de 1 a 7, mientras que las bases tienen valores de pH que van de 7 a 14.
El valor de pH es el logaritmo menos de H+ concentración de iones. El ph 7 se considera como el pH neutral. Los valores de pH superiores a 7 indican la presencia de una base, mientras que los valores inferiores a 7 indican la presencia de ácidos. Según la teoría de Brønsted-Lowry, los ácidos pueden liberar H+ iones mientras que las bases pueden aceptar h+ iones.

CONTENIDO
1. Descripción general y diferencia de claves
2. Que es un ácido
3. Que es una base
4. Comparación de lado a lado: base ácida vs en forma tabular
5. Resumen
Que es un ácido?
Los ácidos son sustancias que tienen pH inferior a 7 en su solución acuosa. La presencia de un medio ácido se puede determinar usando papeles de fuego. Los ácidos pueden volverse rojo. Sin embargo, no hay cambios en el color si se usa el fuego rojo. Los compuestos que tienen átomos de hidrógeno fácilmente ionizables son a menudo ácidos.
Según la teoría de Brønsted-Lowry, un ácido es una sustancia que puede liberar protones (H+ iones) al medio cuando está en un medio acuoso. Cuando h+ se liberan iones, estos iones no pueden existir solos en el medio acuoso. Por lo tanto, estos iones se combinan con moléculas de agua, formando H3O+ iones (iones de hidronio). La presencia de iones de hidronio, por lo tanto, indica la presencia de un ácido.
Según la teoría de Arrhenius, un ácido es una sustancia que puede aumentar la cantidad de iones de hidronio en un medio acuoso. Esto sucede debido al aumento de H+ iones. En otras palabras, los ácidos liberan h+ iones, que pueden interactuar con las moléculas de agua para formar iones de hidronio.
Al considerar la teoría de Lewis, un ácido es un compuesto que puede aceptar un par de electrones a partir de un enlace químico covalente. Según esta definición, las sustancias que no tienen átomos de hidrógeno también se clasifican como ácidos debido a su capacidad para aceptar pares de electrones.
Propiedades de un ácido
Un ácido generalmente tiene un sabor agrio. El pH de un ácido siempre es inferior a 7. Casi todos los ácidos tienen un olor ardiente. La textura de un ácido es pegajosa en lugar de resbaladizo. Además, los ácidos pueden reaccionar con metales (incluso metales altamente no reactivos) para formar hidruro metálico e hidrógeno.
Que es una base?
Una base es una sustancia que muestra un valor de pH superior a 7 cuando está en una solución acuosa. La basicidad de una solución hace que el color de los tornasol rojos se convierta en color azul. Por lo tanto, la presencia de una base se puede determinar usando tornasol rojo. Sin embargo, cuando se usa el fuego azul, no hay cambio de color con una base. Los compuestos que tienen grupos hidroxilo fácilmente ionizables son a menudo bases.
Según la teoría Brønsted-Lowry, una base es un aceptador de protones; En otras palabras, una base puede aceptar protones de un medio acuoso. Sin embargo, la teoría de Arrhenius también ofrece una definición similar: una base es una sustancia que disminuye la cantidad de iones de hidronio presente en un medio. La concentración de iones de hidronio disminuye porque la base obtiene H+ iones o protones del medio acuoso. Estos iones son necesarios para la formación de iones de hidronio.

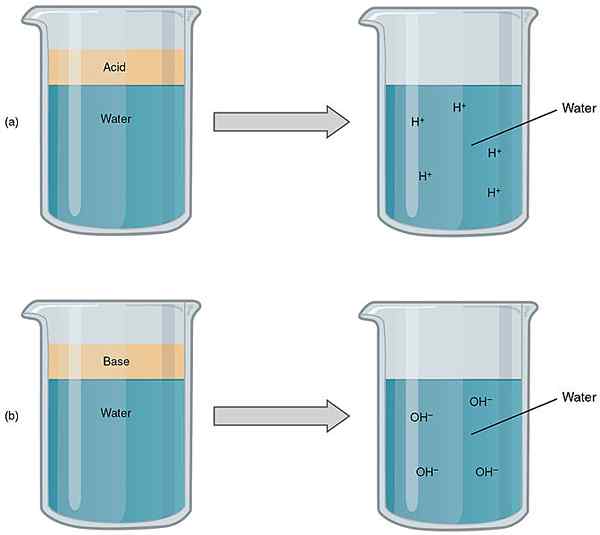
Figura 1: Comparación de ácidos y bases
Al considerar la teoría de Lewis, una base es una sustancia que puede donar pares de electrones. Estas sustancias donan pares de electrones y forman enlaces covalentes de coordenadas. Según esta teoría, la mayoría de los compuestos que no tienen grupos OH se convierten en bases.
Propiedades de una base
Las bases tienen un sabor amargo. Estas sustancias siempre muestran valores de pH superiores a 7. Casi todas las bases son inodoro, excepto el amoníaco. El amoníaco tiene un olor picante. A diferencia de los ácidos, las bases se sienten resbaladizas. Las bases se neutralizan cuando se reaccionan con ácidos.
¿Cuál es la diferencia entre ácido y base??
Ácido vs base | |
| Un ácido es una sustancia que muestra un valor de pH inferior a 7 cuando está en una solución acuosa | Una base es una sustancia que muestra un valor de pH superior a 7 cuando está en una solución acuosa |
| Definición basada en la teoría de la luz de Brønsted | |
| Un ácido es una sustancia que puede liberar protones (iones H+) al medio cuando está en un medio acuoso. | Una base es un aceptador de protones; En otras palabras, una base puede aceptar protones de un medio acuoso. |
| Definición basada en la teoría de Arrhenius | |
| Un ácido es una sustancia que puede aumentar la cantidad de iones de hidronio en un medio acuoso. | Una base es una sustancia que puede disminuir la cantidad de iones de hidronio en un medio acuoso. |
| Definición basada en la teoría de Lewis | |
| Un ácido es un compuesto que puede aceptar un par de electrones a partir de un enlace químico covalente. | Una base es una sustancia que puede donar pares de electrones. |
| Cambio de color en el tornasol | |
| Los ácidos pueden volverse rojo azul, pero no hay cambio de color en los tornasol rojos. | Las bases pueden convertirse en azul rojo, pero no hay un cambio de color en el tornasol azul. |
| Gusto | |
| El SIDA tiene un sabor agrio. | Las bases tienen un sabor amargo. |
| Olor | |
| Los ácidos tienen un olor ardiente. | Las bases son inodoro, excepto el amoníaco. |
| Ionización | |
| Los ácidos pueden formar iones de hidronio cuando se ionizan. | Las bases pueden formar iones hidroxilo cuando se ionizan. |
| Especies químicas conjugadas | |
| La especie conjugada de un ácido es su base conjugada. | La especie conjugada de una base es su ácido conjugado. |
| Neutralización | |
| Un ácido puede neutralizarse usando una base. | Una base se puede neutralizar usando un ácido. |
| Valoración | |
| Los ácidos se titulan con bases para la neutralización. | Las bases se reaccionan con ácidos para la neutralización. |
Resumen - ácido vs base
Todos los compuestos se pueden clasificar en ácidos, bases y compuestos neutros. La diferencia clave entre el ácido y la base es que los ácidos tienen valores de pH que varían de 1 a 7, mientras que las bases tienen valores de pH que varían de 7 a 14.
Referencia:
1. Helmenstine, Anne Marie. "Esto es lo que es un ácido en química."Thinkco, disponible aquí.
2. Helmenstine, Anne Marie. “Definiciones clave de ácidos y bases."Thinkco, disponible aquí.
3. Bibliotecas. "Descripción general de ácidos y bases."Bibliotecas de química, Librettexts, 13 de febrero. 2017, disponible aquí.
Imagen de cortesía:
1. "215 ácidos y bases -01" por OpenStax College - Anatomía y fisiología, Sitio web de Connexions, 19 de junio de 2013 (CC por 3.0) a través de Commons Wikimedia


