Diferencia entre la titulación ácida-base y la titulación redox
Diferencia clave: titulación ácida -base vs. Titulación redox
En general, las titulaciones se utilizan para determinar la concentración de una solución desconocida (analito). Los dos métodos titrimétricos más utilizados son las valoraciones de base ácida y las titulaciones redox. El diferencia clave entre las titulaciones de la base ácida y las titulaciones redox es la naturaleza de la reacción que ocurre entre el titular y el analito en la titulación. En las titulaciones ácido-base, tiene lugar una reacción de neutralización y en las titulaciones redox, tiene lugar una reacción redox (una reacción oxidante y una reacción de reducción). El uso de indicadores es el método más utilizado para determinar el punto final de la reacción.
¿Qué es una titulación de base ácida??
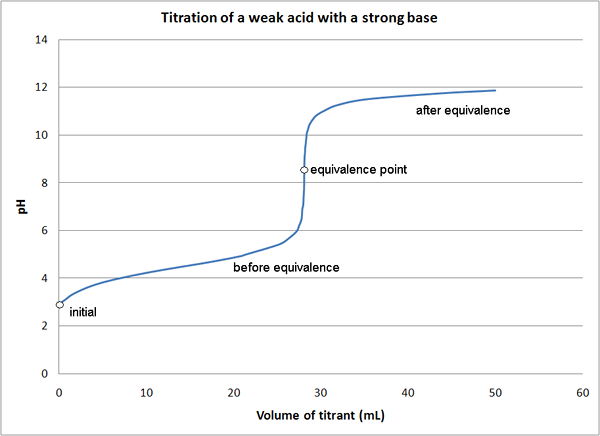
En las titulaciones de base ácida, se usa un ácido (titulaciones ácidas) o una base (titulaciones básicas) como titulador. Los ejemplos de ácidos utilizados en titulaciones ácidas son h2ENTONCES4, HCL, o HNO3. La mayoría de los titulizantes básicos utilizados son NaOH, K2CO3 o na2CO3. Las titulaciones ácido-base se pueden clasificar de la siguiente manera dependiendo de la resistencia del ácido y la base.
- Ácido fuerte: titulaciones de base fuertes
- Titulaciones de base de ácido fuerte y débiles
- Ácido débil: titulaciones de base fuertes
- Ácido débil: titulaciones de base débiles
En la mayoría de las titulaciones ácido-base, se utilizan indicadores para determinar el punto final de la reacción. Se utilizan diferentes indicadores dependiendo del tipo de titulación como se mencionó anteriormente.

¿Qué es una titulación redox??
Una titulación redox implica una reacción redox. La reacción redox tiene dos reacciones; una reacción de oxidación y una reacción de reducción. Los procesos de oxidación y reducción tienen lugar al mismo tiempo que nos permiten determinar la finalización de la reacción. Esto también se conoce como el punto final de la titulación. Esto se puede determinar de varias maneras; Usando electrodos indicadores, los indicadores redox (el indicador produce un color diferente en el estado de reducción de oxidación) e indicadores no redox (el indicador produce un color cuando se agrega un exceso de titulante).

¿Cuál es la diferencia entre la titulación ácida-base y la titulación redox??
Naturaleza de la reacción:
Titulación de base ácida: Una titulación ácida-base implica una reacción de neutralización entre el analito (la solución con la concentración desconocida) y el titulador ácido o básico.
Titulación redox: Una reacción redox implica una reacción de oxidación y reducción entre el analito y el titulador. No existe tal regla que el componente oxida y cuál reduzca. Ya sea el analito o el titrante oxida, y el componente restante se reduce en consecuencia.
Determinación del punto final:
Titulación de base ácida: En general, se usa un indicador de pH, un medidor de pH o un medidor de conductancia para determinar el punto final de una titulación de base ácida.
Titulación redox: Los métodos más utilizados para determinar el punto final de una reacción redox son usar un potenciómetro o un indicador redox. Pero, con mayor frecuencia, el analito o el titulador producen un color en el punto final. De modo que no se requieren indicadores adicionales en esos casos.
Ejemplos:
Titulación de base ácida:
| Tipo | Reacción (indicador) |
| Ácido fuerte: titulación de base fuerte | HCL + NaOHàNACL + H2O (fenolftaleína /metil naranja) |
| Ácido fuerte - titulación de base débil | HCL + NH3à nh3CL (Metil Orange) |
| Ácido débil - titulación de base fuerte | Pez3COOH + NaOHà CH3Coona + H2O (fenolphthalein) |
| Titulación de base de ácido débil | Pez3COOH + NH3ióch3ARRULLO-+NUEVA HAMPSHIRE4+(No hay indicadores adecuados) |
Titulación redox:
2 kmno4 + 5 H2C2O4 + 6 HCL → 2 MNCL2 + 2KCL + 10 CO2 + 8 h2O
(+7) (+3) (+2) (+4)
En la reacción anterior, el permanganato se reduce mientras se oxida el ácido oxálico. Cuando se completa la reacción, el color púrpura del permanganato cambia a incoloro.
Cárcel4 + 5FECL2 +8HCL → 5FECL3+MNCL2+KCL+4H2O
(+7) (+2) (+3) (+2)
Imagen de cortesía:
1. Titulación de ácido débil con una base fuerte por Quantumkinetics (trabajo propio) [CC por 3.0], a través de Wikimedia Commons
2. "Titulación previa de titulación Winkler" de Willwood [CC BY-SA 3.0] a través de Commons


