Diferencia entre la constante de ionización ácida y la constante de ionización de la base
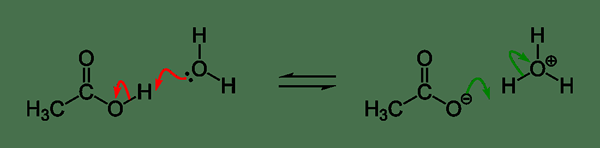
Diferencia clave: ionización ácida Constante VS constante de ionización base
La constante de ionización ácida (KA, también conocida como constante de disociación ácida) da la medición cuantitativa del equilibrio que existe entre las moléculas ácido y sus formas ionizadas. Del mismo modo, la constante de ionización de la base (Kb o constante de disociación de base) proporciona la medición cuantitativa del equilibrio que existe entre las moléculas base y sus formas ionizadas. El diferencia clave entre la constante de ionización ácida y la constante de ionización de la base es que La constante de ionización ácida proporciona una medida cuantitativa de la resistencia de un ácido en una solución, mientras que la constante de ionización de la base da una medida cuantitativa de la resistencia de una base en una solución.
La ionización es la separación de moléculas en especies iónicas (cationes y aniones). La constante de equilibrio es la relación entre las cantidades de reactivos y productos que están en equilibrio entre sí.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es constante de ionización ácida?
3. ¿Qué es constante de ionización base?
4. Comparación de lado a lado - Constante de ionización ácida frente a la constante de ionización de base en forma tabular
5. Resumen
¿Qué es constante de ionización ácida??
La constante de ionización ácida es el número que expresa la relación entre las moléculas ácidas y las especies iónicas que existen en la misma solución. La constante de disociación ácida se denota por KA. Es una medida cuantitativa de la resistencia de un ácido en una solución. La fuerza de un ácido depende de la ionización (o disociación) de un ácido en una solución acuosa.
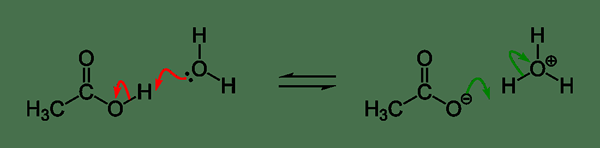
Figura 01: Un ejemplo para la ionización ácida
La ionización de un ácido se puede administrar a continuación,
Ha + h2O ↔ A- + H3O+
En esto, HA es un ácido débil que se disocia parcialmente en iones; El anión se conoce como la base conjugada de ese ácido en particular. La disociación ácida libera un proton (ion de hidrógeno; H+). Este protón se combina con una molécula de agua que forma un ion hidronio (H3O+). La constante de ionización ácida de este ácido de HA se puede administrar como se muestra a continuación,
Ka = [A-] [H3O+] / [Ja] [h2O]
La forma común de ka es pka, que es el valor de registro menos de ka. Esto se debe a que los valores de KA son valores muy pequeños y son difíciles de manejar. El PKA ofrece un número simple que es fácil de manejar. Se puede dar a continuación,
pka = -log (ka)
Los valores de KA o PKA se pueden usar para expresar la resistencia de un ácido.
- Los ácidos débiles tienen valores de KA más bajos y valores de PKA más altos
- Los ácidos fuertes tienen valores de KA más altos y valores de PKA más bajos.
¿Qué es constante de ionización base??
La constante de ionización base es el número que expresa la relación entre las moléculas base y las especies iónicas existen en la misma solución. Esto es denotado por KB. Mide la resistencia de una base en una solución. Más alto el KB, mayor la ionización de la base. Para una determinada base en una solución, la constante de disociación base se puede administrar como se muestra a continuación,
B+ H2O ↔ bh+ + OH-
KB = [BH+][OH-] / [B] [H2O]
Dado que los valores de KB de las bases son valores muy pequeños, el valor de registro menos de KB se usa en su lugar KB. El valor de registro menos de KB se denota por PKB. PKB ofrece un número que es fácil de manejar.
pkb = -log (KB)
La fuerza de una base puede expresarse por valores de KB o valores de PKB de la siguiente manera.
- Mayor el valor de la constante de ionización base, más fuerte la base (más bajo el PKB)
- Baje el valor de la constante de ionización de la base, más débil la base (más alto el PKB)
¿Cuál es la diferencia entre la constante de ionización ácida y la constante de ionización base??
Constante de ionización ácida vs ionización base constante | |
| La constante de ionización ácida es el número que expresa la relación entre las moléculas ácidas y las especies iónicas existentes en la misma solución. | La constante de ionización base es el número que expresa la relación entre las moléculas base y las especies iónicas existentes en la misma solución. |
| Concepto | |
| La constante de ionización ácida da la resistencia de un ácido. | La constante de ionización de la base da la fuerza de una base. |
| Valor de registro | |
| El valor de registro menos de KA es PKA. | El valor de registro menos de KB es PKB. |
| Valor de la constante | |
| Los ácidos débiles tienen valores de KA más bajos y valores de PKA más altos, mientras que los ácidos fuertes tienen valores de KA más altos y valores de PKA más bajos. | Las bases débiles tienen valores de KB más bajos y valores de PKB más altos, mientras que las bases fuertes tienen valores de KB más altos y valores de PKB más bajos. |
Resumen - Ionización ácida Constante VS constante de ionización base
Constante de ionización ácida y la constante de ionización base son medidas de ácido y resistencias base respectivamente. La diferencia entre la constante de ionización ácida y la constante de ionización de la base es que la constante de ionización ácida da una medida cuantitativa de la resistencia de un ácido en una solución, mientras que la constante de ionización de la base da una medida cuantitativa de la resistencia de una base en una solución.
Referencia:
1."dieciséis.4: resistencia al ácido y la constante de disociación ácida (KA)."Bibliotecas de química, Librettexts, 26 de febrero. 2017. Disponible aquí
2.“Bases fuertes y débiles y constante de ionización base (KB)."Fundación CK-12, Fundación CK-12, 11 de septiembre. 2016. Disponible aquí
3.“Ácidos y bases: constantes de ionización.Ionización de ácidos y bases. Disponible aquí
Imagen de cortesía:
1.'Acetic-ácido-disociación-2D-Curly-Arrows'by Ben Mills-Trabajo propio, (dominio público) a través de Commons Wikimedia


