Diferencia entre acidez y basicidad

Diferencia clave: acidez vs basicidad
Acidez y basicidad de los compuestos son indicaciones del pH. La acidez de un medio es causada por compuestos ácidos, que pueden liberar iones de hidrógeno (H+), lo que resulta en un pH bajo en ese medio. La basicidad de un medio es causada por compuestos básicos, que pueden liberar iones de hidróxido (OH-), lo que resulta en un pH alto en ese medio. La diferencia clave entre la acidez y la basicidad es que La acidez provoca un pH bajo, mientras que la basicidad causa un pH alto en un medio acuoso.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es la acidez
3. Que es la basicidad
4. Comparación de lado a lado: acidez frente a basicidad en forma tabular
5. Resumen
Que es la acidez?
La acidez es el nivel de ácido en las sustancias. La concentración de iones de hidrógeno (H+) es el parámetro principal utilizado para identificar la acidez. La concentración de iones de hidrógeno se expresa como un valor de pH. El pH es el logaritmo negativo de la concentración de iones de hidrógeno. Por lo tanto, mayor la concentración de iones de hidrógeno, disminuya el pH. Un valor de pH bajo indica una mayor acidez.
Según la acidez de las sustancias, hay dos tipos de ácidos como ácidos fuertes y ácidos débiles. Los ácidos fuertes causan un mayor nivel de acidez en medio acuoso, mientras que los ácidos débiles dan como resultado una baja acidez. Los ácidos fuertes pueden disociarse completamente en iones, liberando todos los iones de hidrógeno posibles (h+). En contraste, un ácido débil se disocia parcialmente, liberando solo algunos iones de hidrógeno. Los ácidos también se pueden clasificar como ácidos monopróticos y ácidos polipróticos; Los ácidos monopróticos liberan un ion de hidrógeno por molécula, mientras que los ácidos polipóticos liberan más iones de hidrógeno por molécula.
La acidez de los ácidos está determinada por el PKA del ácido. PKA es el logaritmo negativo de KA. KA es la constante de disociación ácida de una solución. Es una medición cuantitativa de la resistencia de un ácido en una solución (o acidez). Bajo el pka, más fuerte es el ácido. Mayor el pka, más débil es el ácido.

Figura 01: el jugo de limón tiene una alta acidez
Las tendencias periódicas de acidez de los elementos químicos dependen básicamente de sus valores de electronegatividad.La electronegatividad de los elementos químicos aumenta de izquierda a derecha de un período. Si la electronegatividad de un átomo es mayor, puede estabilizar un átomo negativo en él muy fácilmente porque tiene una mayor afinidad por los electrones. Por lo tanto, los iones de hidrógeno asociados con átomos electronegativos altos se liberan fácilmente que los átomos electronegativos bajos, lo que resulta en una mayor acidez. Al bajar un grupo en la tabla periódica, la acidez aumenta. Esto se debe a que el tamaño de los átomos aumenta el grupo. Los átomos grandes pueden estabilizar cargas negativas sobre ellos (por distribución de carga); por lo tanto, se puede liberar un ion de hidrógeno asociado con un átomo grande.
Que es la basicidad?
La basicidad de una sustancia es el número de átomos de hidrógeno reemplazables por una base en un ácido particular. En otras palabras, la basicidad de un compuesto es el número de iones de hidrógeno que pueden reaccionar completamente con los iones de hidróxido liberados por una base.
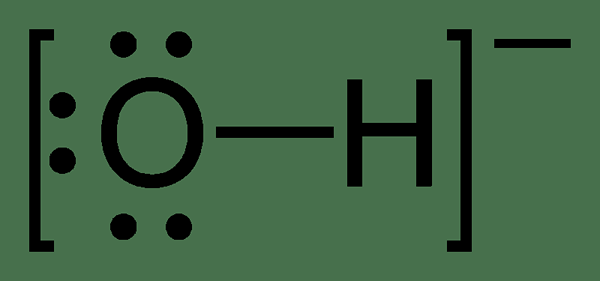
Figura 02: Estructura química del ion hidróxido
Los factores que pueden afectar la basicidad de un compuesto se enumeran a continuación.
- Electronegatividad
- Radio atómico
- Cargos formales
La electronegatividad de un átomo se refiere a su afinidad por los electrones. Un átomo que tiene una alta electronegatividad puede atraer electrones en comparación con los bajos átomos electronegativos. Mayor la electronegatividad, menor la basicidad. Para liberar el ion hidróxido, los electrones de enlace entre el átomo de oxígeno y el resto de la molécula deben ser atraídos por completo por el átomo de oxígeno (el átomo de oxígeno en el grupo de hidróxido debe ser más electronegativo que el otro átomo al que está unido). Ej: Si la basicidad de ROH es alta, la electronegatividad de R es menor que la del átomo de oxígeno.

Figura 03: los jabones son bases débiles formadas por la reacción de ácidos grasos con hidróxido de sodio o hidróxido de potasio.
El radio atómico es otro factor que afecta la basicidad de un compuesto. Si el radio atómico es pequeño, la densidad electrónica de ese átomo es alta. Por lo tanto, el ion hidróxido se puede liberar fácilmente. Entonces la basicidad de ese compuesto es relativamente alta.
Los cargos formales son generalmente cargos positivos o cargos negativos. Una carga formal positiva indica una menor densidad de electrones. Por lo tanto, los electrones de enlace no pueden ser atraídos por el ion hidróxido. Entonces no se puede liberar fácilmente (el ion hidróxido), lo que indica una menor basicidad. En contraste, una carga formal negativa causa una mayor basicidad.
¿Cuál es la diferencia entre acidez y basicidad??
Acidez vs basicidad | |
| La acidez es el nivel de ácido en las sustancias. | La basicidad se refiere al estado de ser una base, que puede liberar iones de hidróxido (OH-). |
| ph | |
| La acidez provoca un pH bajo en medios acuosos. | La basicidad causa un pH alto en medios acuosos. |
| Iones | |
| La acidez indica una alta concentración de iones de hidrógeno en un medio. | La basicidad indica una alta concentración de iones de hidróxido en un medio. |
| Tendencias periódicas | |
| La acidez aumenta de izquierda a derecha un período y en un grupo. | La basicidad disminuye de izquierda a derecha un período y en un grupo. |
| Efecto de la electronegatividad | |
| La acidez es alta si la electronegatividad (del átomo al que se une el átomo de hidrógeno) es alta. | La basicidad es alta si la electronegatividad (del átomo al que se une el átomo de oxígeno del ion hidróxido). |
Resumen - Acidez vs Basicidad
La acidez y la basicidad son dos términos fundamentales utilizados en la química. La acidez es causada por compuestos ácidos. La basicidad es causada por compuestos básicos. La diferencia clave entre la acidez y la basicidad es que la acidez causa un pH bajo, mientras que la basicidad causa un pH alto en un medio acuoso.
Referencia:
1. "7.3: Efectos estructurales sobre la acidez y la basicidad."Bibliotecas de química, Librettexts, 7 de septiembre. 2016, disponible aquí.
2. "Tendencia de la tabla periódica."Red de médico estudiantil, disponible aquí.
Imagen de cortesía:
1. "Lemon-Edit1" de André Karwath AKA-AKA-Own Work (CC By-Sa 2.5) Vía Commons Wikimedia
2. "Hydroxide-Lone-Pairs-2d" (dominio público) a través de Commons Wikimedia
3. "589824" (CC0) a través de Pixabay