Diferencia entre actínidos y lantánidos
El diferencia clave entre actínidos y lantánidos es que el Actinides llenan electrones a 5F suborbitales, mientras que los lantánidos llenan electrones de hasta 4F suborbitales.
Los lantánidos y los actínidos ocurren en dos filas separadas en la tabla periódica. Por lo tanto, ambos pertenecen al bloque F. Es porque tienen sus electrones más externos en los orbitales F. Por lo tanto, podemos nombrarlos como elementos de bloque f.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que son actinides
3. ¿Qué son los lantánidos?
4. Comparación de lado a lado - Actinides vs Lanthanides en forma tabular
5. Resumen
Que son actinides?
Actinides es un conjunto de elementos en la tabla periódica con los números atómicos que van desde 90 a 103. En consecuencia, hay 14 elementos de metal que incluyen los siguientes:
- torio th (z = 90)
- Protactinium PA (91)
- uranio u (92)
- Neptunium NP (93)
- Plutonio PU (94)
- America AM (95)
- Curium CM (96)
- Berkelium BK (97)
- Californium CF (98)
- Einsteinium es (99)
- Fermium FM (100)
- Mendelevium MD (101)
- una unidad ї 102
- Lawrencium LR (103).
Los nombramos como elementos de bloque f; porque sus electrones finales están en un suborbital F. Todos los actínidos son inestables; Por lo tanto, todos son radiactivos. Dado que son metales, son altamente electropositivos. Además, son metales densos, y numerosos alotropas están presentes. Estos metales empañan fácilmente en el aire y reaccionan con agua hirviendo o ácido diluido que libera gas de hidrógeno.

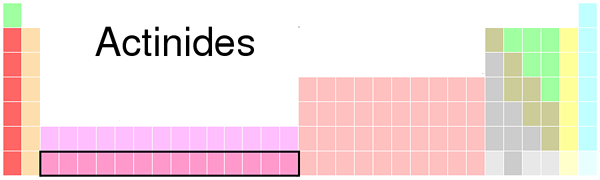
Figura 01: Ubicación de actina en la tabla periódica
Al igual que otros metales, también pueden formar compuestos con elementos no metálicos. Además, podemos encontrar actínidos en el entorno natural, aunque algunos son muy raros. Por ejemplo, el uranio y el torio están presentes como depósitos, en Canadá. Debido a su radiactividad, la mayoría de los actínidos son útiles en la producción de energía nuclear. Podemos producir elementos de actínide sintéticamente para usarlos para diversos fines. Aparte de eso, algunos de ellos son útiles para fines medicinales, identificación mineral, radiografía de neutrones, etc.
¿Qué son los lantánidos??
Los lantánidos contienen elementos del número atómico 57 a 71. Hay 15 elementos metálicos. Estos elementos incluyen los siguientes:
- Lanthanum la (57)
- Cerium CE (58)
- Prasodymio PR (59)
- Neodymium nd (60)
- Prometium PM (61)
- Samarium SM (62)
- Europium EU (63)
- Gadolinium GD (64)
- Terbium TB (65)
- Dysprosium DY (66)
- Holmium Ho (67)
- YTTRIUM ER (68)
- Thulium TM (69)
- YTTERBIUM YB (70)
- Lutetium Lu (71).
Estos pertenecen al bloque F en la tabla periódica; Por lo tanto, los electrones finales se llenan en el suborbital 4F. Allí, otros suborbitales cubren los orbitales 4F, y la química de los lantánidos difieren debido al tamaño del átomo. Muestran +3 estado de oxidación. Además, de izquierda a derecha de una fila en la tabla periódica, el tamaño de +3 iones de lantánidos disminuye, y lo llamamos como contracción de lantánidos.
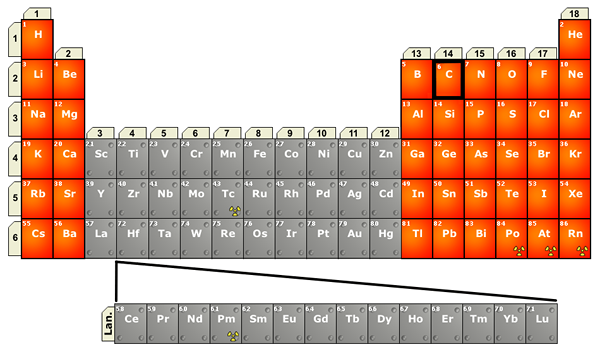
Figura 02: Ubicación de los lantánidos en la tabla periódica
Además, los lantánidos son metales de color plateado, que reaccionan fácilmente con oxígeno en el aire para producir sus óxidos. Estos son metales altamente reactivos y relativamente suaves con altos puntos de fusión y puntos de ebullición. Además, forman fácilmente compuestos iónicos con no metales. Al reaccionar con ácido diluido o lantánidos de agua produce gas hidrógeno.
Además de eso, estos elementos tienen electrones no apareados (excepto Lutetium), que son responsables de sus propiedades paramagnéticas. Además, los nombramos como metales de tierras raras debido a la baja abundancia en la superficie de la tierra. Aunque son raros, hay muchos usos de estos elementos. Por lo tanto, son útiles como catalizadores en la producción de vidrio, petróleo, etc. Además, son útiles en imanes, fósforos, lámparas, superconductores, aplicaciones optoelectrónicas, etc.
¿Cuál es la diferencia entre actínidos y lantánidos??
ActInides es un conjunto de elementos en la tabla periódica con los números atómicos que van desde 90 a 103, mientras que los lantánidos son un conjunto de elementos en la tabla periódica con números atómicos 57 a 71. La diferencia clave entre actínidos y lantánidos es que los actínidos llenan electrones a 5F suborbitales, mientras que los lantánidos llenan electrones de hasta 4F suborbitales. Además, todos los actínidos son radiactivos, pero los lantánidos no lo son (excepto Prometium). Como otra diferencia entre los actínidos y los lantánidos, podemos decir que los lantánidos muestran el estado de oxidación máximo +4 mientras que los actínidos muestran los estados de oxidación +3, +4, +5, +6 y +7 de oxidación.
A continuación, la infografía presenta un resumen de comparación de la diferencia entre actínidos y lantánidos.

Resumen -Actinides vs Lanthanides
ActInides es un conjunto de elementos en la tabla periódica con los números atómicos que van desde 90 a 103, mientras que los lantánidos son un conjunto de elementos en la tabla periódica con números atómicos 57 a 71. Por lo tanto, su diferencia clave existe en su configuración de electrones. Por lo tanto, la diferencia clave entre los actínidos y los lantánidos es que los actínidos llenan electrones a 5F suborbitales, mientras que los lantánidos llenan electrones de hasta 4F suborbitales.
Referencia:
1. Bibliotecas. "Lantánidos: propiedades y reacciones."Bibliotecas de química, National Science Foundation, 26 de noviembre. 2018. Disponible aquí
2. Bibliotecas. "Los actinides."Bibliotecas de química, National Science Foundation, 26 de noviembre. 2018. Disponible aquí
Imagen de cortesía:
1."Actinide-Table" (CC BY-SA 3.0) a través de Commons Wikimedia
2."Orgchem Maingrp Metals of InterestDpSerived" por Leprof 7272 - Trabajo propio, (CC BY -SA 3.0) a través de Commons Wikimedia


