Diferencia entre el complejo activado y el estado de transición
Complejo activado vs estado de transición | Complejo de transición vs complejo de activación
Cuando uno o más reactivos se están convirtiendo a productos, pueden pasar por diferentes modificaciones y cambios de energía. Los enlaces químicos en los reactivos se están rompiendo, y se están formando nuevos enlaces para generar productos, que son totalmente diferentes de los reactivos. Esta modificación química se conoce como reacciones químicas. Hay numerosas variables que controlan las reacciones. Para que se realice una reacción, debe haber energía requerida. Las moléculas reactivas pasan por cambios a lo largo de la reacción suponiendo varias configuraciones atómicas. Complejo activado y estado de transiciones son dos terminologías utilizadas para identificar estos complejos intermedios y la mayoría de las veces estos dos términos se usan indistintamente.
¿Qué es el complejo activado??
Se debe activar una molécula antes de que puedan someterse a una reacción. Las moléculas normalmente no tienen mucha energía con ellas, solo ocasionalmente algunas moléculas están en un estado de energía para sufrir reacciones. Donde hay dos reactivos, para que ocurra la reacción, los reactivos deben chocar entre sí en la orientación adecuada. Aunque los reactivos se encuentran entre sí, la mayoría de los encuentros no están conduciendo a una reacción. Estas observaciones han dado la idea de tener una barrera de energía a las reacciones. Los reactivos con estados de energía más altos en la mezcla de reacción pueden considerarse como complejos activados. No todos los complejos activados pueden ir a los productos, pueden volver a caer a los reactivos si no tienen suficiente energía.
¿Qué es el estado de transición??
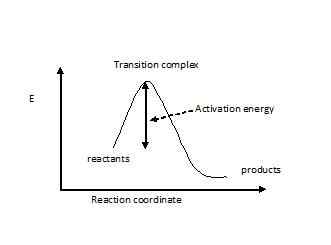
El estado de transición se piensa en uno en el que la molécula de reacción se tensa o se distorsiona o tiene una configuración electrónica desfavorable. La molécula debe pasar a través de este estado de transición de alta energía antes de que ocurra la reacción. La brecha energética se conoce como energía de activación. Esta es la barrera de energía más alta para una reacción. Si la activación para una reacción es demasiado alta, solo una pequeña fracción de moléculas tendrá suficiente energía para superarla, por lo que la concentración de productos esperado no se obtendrá. La disposición atómica de todas las moléculas en la reacción, que tiene la energía de activación, se llama complejo de transición. El complejo de transición tiene componentes con enlaces parcialmente rotos y nuevos enlaces realizados parcialmente. Por lo tanto, tiene cargas parciales negativas y positivas. El estado de transición se muestra con un signo de doble daga (‡). Si se puede reducir la energía del estado de transición de una reacción, entonces la reacción debe ser mucho más rápida y requerirá baja energía para proceder. Para una reacción exotérmica, la siguiente es la curva de energía.
 Es esencial conocer las estructuras del estado de transición, especialmente al diseñar los medicamentos para la inhibición de la enzima.
Es esencial conocer las estructuras del estado de transición, especialmente al diseñar los medicamentos para la inhibición de la enzima.
|
¿Cuál es la diferencia entre el complejo activado y el estado de transición?? • El estado de transición es la disposición atómica con la energía más alta cuando los reactivos van a los productos. Los complejos activados son todas las otras configuraciones en la vía de reacción, que tienen una mayor energía que las moléculas normales. • Existe una alta posibilidad de un complejo de estado de transición para ir a los productos. Sin embargo, los complejos de activación pueden recurrir para formar reactivos que ir a los productos.
|


