Diferencia entre la teoría compleja activada y la teoría de la colisión
El diferencia clave Entre la teoría del complejo activado y la teoría de la colisión es que La teoría del complejo activado es más precisa y confiable al describir las tasas de reacción, mientras que la teoría de la colisión es menos confiable.
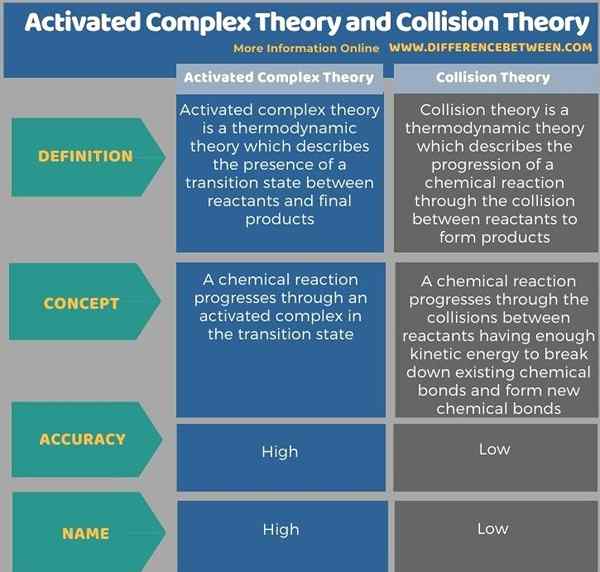
La teoría compleja activada y la teoría de la colisión son dos conceptos importantes que describen la termodinámica de las reacciones químicas. Estas teorías pueden usarse para predecir las velocidades de reacción de las reacciones químicas. La teoría del complejo activado también se llama Teoría del estado de transición. Sin embargo, la teoría del complejo activado se considera más precisa en comparación con la teoría de la colisión.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la teoría del complejo activado?
3. ¿Qué es la teoría de la colisión?
4. Comparación de lado a lado: teoría compleja activada frente a la teoría de colisión en forma tabular
5. Resumen
¿Qué es la teoría del complejo activado??
La teoría del complejo activado es una teoría termodinámica que describe la presencia de un estado de transición entre los reactivos y los productos finales. Por lo tanto, también se llama la teoría del estado de transición o Teoría TST. Esta teoría proporciona información más precisa y confiable en comparación con la teoría de colisiones. Esta teoría fue desarrollada por Henry Eyring en 1935.
La teoría del complejo activado describe la energía de activación (EA) de una mezcla de reacción y las propiedades termodinámicas que involucran el estado de transición. Esta teoría es un desarrollo de la teoría de la colisión y utiliza la base de la ecuación de Arrhenius. Además, esta teoría describe el factor de frecuencia estadística, V, que es un factor fundamental de esta teoría.
Según la teoría del complejo activado, existe un estado intermedio entre el estado de los reactivos y el estado de los productos de una mezcla de reacción. Se llama estado de transición, que contiene un compuesto complejo activado. Este complejo activado se forma mediante la combinación de reactivos. Según esta teoría, hay hechos principales que debemos considerar para determinar si la reacción ocurrirá. Los hechos son los siguientes:
- La concentración del complejo activado en el estado de transición
- La tasa de desglose de este complejo activado
- La forma del desglose del complejo activado (el complejo puede romperse formando los productos o puede formar reactivos nuevamente)
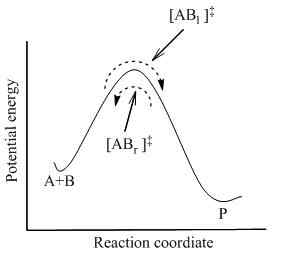
Además de eso, la teoría del complejo activado también sugiere el concepto de energía de activación con respecto a una reacción química. La energía de activación es la barrera de energía de la reacción; Una cierta cantidad de energía es esencial para que ocurra una reacción química. El complejo activado es un complejo de alta energía que es inestable, y tiene la máxima energía del proceso de reacción. Si la mezcla de reacción obtiene una cantidad de energía igual a esta energía de activación, entonces la mezcla de reacción puede superar la barrera de energía y dar productos de la reacción.
¿Qué es la teoría de la colisión??
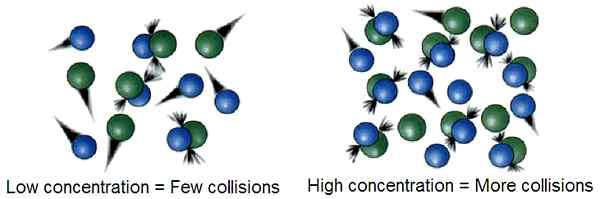
La teoría de la colisión es una teoría termodinámica que describe la progresión de una reacción química a través de la colisión entre reactivos para formar productos. Según esta teoría, si dos moléculas chocan entre sí para que tenga lugar una reacción química, los factores que influyen en la facilidad de la colisión son importantes para predecir la progresión de la reacción. mi.gramo. Cuanta más energía se suministre a la mezcla de reacción, más rápido se mueven los reactivos, chocando entre sí. Del mismo modo, las condiciones de alta temperatura pueden causar más colisiones entre reactivos y altas tasas de reacción.

En la teoría de la colisión, la velocidad a la que las moléculas reactivas chocan entre sí se denominan frecuencia de colisión, z. Da las unidades de colisiones por unidad de tiempo. Según la teoría de la colisión, la energía de la mezcla de reactivos y la concentración de los reactivos afectan la velocidad de reacción. Sin embargo, para que ocurra una colisión exitosa entre los reactivos, los reactivos deben chocar entre sí con suficiente energía cinética para descomponer los enlaces químicos en los reactivos y para formar nuevos enlaces químicos, formando el producto final. Esta cantidad de energía se nombra como energía de activación.
¿Cuál es la diferencia entre la teoría compleja activada y la teoría de la colisión??
La teoría compleja activada y la teoría de la colisión son importantes teorías termodinámicas. La diferencia clave entre la teoría del complejo activado y la teoría de la colisión es que la teoría del complejo activado es más precisa y confiable al describir las tasas de reacción, mientras que la teoría de la colisión es menos confiable.
A continuación, la infografía tabula las diferencias entre la teoría del complejo activado y la teoría de la colisión con más detalle.
Resumen -Teoría compleja activada frente a la teoría de colisión
La teoría compleja activada y la teoría de la colisión son importantes teorías termodinámicas. La diferencia clave entre la teoría del complejo activado y la teoría de la colisión es que la teoría del complejo activado es más precisa y confiable al describir las tasas de reacción, mientras que la teoría de la colisión es menos confiable.
Referencia:
1. "Complejo activado." Wikipedia, Fundación Wikimedia, 18 de junio de 2020, disponible aquí.
2. "9.7: Teorías de las tasas de reacción."Bibliotecas de química, Librettexts, 1 de septiembre. 2020, disponible aquí.
Imagen de cortesía:
1. "Quasi -Equilibrium1" por Chem540Grp1F08 - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Colisiones moleculares" de SADI_CARNOT -(dominio público) a través de Commons Wikimedia


