Diferencia entre la energía de activación y la energía umbral
El diferencia clave entre la energía de activación y la energía umbral es que el La energía de activación describe la diferencia de energía potencial entre los reactivos y el complejo activado, mientras que la energía umbral describe la energía requerida por los reactivos para chocar entre sí con éxito para formar el complejo activado.
La energía es la capacidad de trabajar. Si hay suficiente energía, podemos usar esa energía para hacer un trabajo que deseamos; En química, este trabajo puede ser una reacción química o una reacción nuclear. La energía de activación y la energía umbral son dos términos que usamos en química para definir dos formas diferentes de energía.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la energía de activación?
3. ¿Qué es la energía umbral?
4. Comparación de lado a lado - Energía de activación versus energía umbral en forma tabular
5. Resumen
¿Qué es la energía de activación??
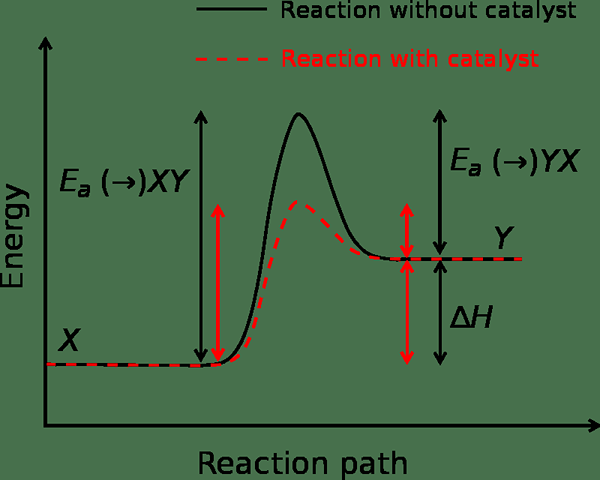
La energía de activación es una forma de energía que necesitamos para activar una reacción química o nuclear o cualquier otra reacción. La mayoría de las veces, medimos esta forma de energía en la unidad kilojulios por lunar (kJ/mol). Esta forma de energía es la barrera de energía potencial que evita que una reacción química progrese. Esto significa que evita que los reactivos se conviertan en los productos. Además, para progresar una reacción química en un sistema termodinámico, el sistema debe alcanzar una temperatura alta que sea suficiente para proporcionar a los reactivos una energía igual o mayor que la barrera de energía de activación.

Figura 01: Velocidad de reacción en ausencia y presencia de un catalizador
Si el sistema obtiene suficiente energía, entonces la velocidad de reacción aumenta. Sin embargo, en algunos casos, la velocidad de reacción disminuye cuando aumentamos la temperatura. Esto se debe a la energía de activación negativa. Podemos calcular la velocidad de reacción y la energía de activación utilizando la ecuación de Arrhenius. Es como sigue:
K = AE-mia/(RT)
Dónde k es el coeficiente de velocidad de reacción, a es el factor de frecuencia para la reacción, r es la constante de gas universal y t es la temperatura absoluta. Entonces Ea es la energía de activación.
Además de eso, los catalizadores son sustancias que pueden reducir la barrera de energía de activación para una reacción. lo hace modificando el estado de transición de la reacción. Además, la reacción no consume el catalizador mientras progresa la reacción.
¿Qué es la energía umbral??
La energía umbral es la energía mínima que debe tener un par de partículas para someterse a una colisión exitosa. Este término es muy útil en física de partículas en lugar de en química. Aquí, hablamos de la energía cinética de las partículas. Esta colisión de partículas forma el complejo activado (intermedio) de una reacción. Por lo tanto, la energía umbral es igual a la suma de energía cinética y energía de activación. Por lo tanto, esta forma de energía siempre es igual o mayor que la energía de activación.
¿Cuál es la diferencia entre la energía de activación y la energía umbral??
La energía de activación es una forma de energía que necesitamos para activar una reacción química o nuclear o cualquier otra reacción. Describe la diferencia de energía potencial entre los reactivos y el complejo activado. Además, su valor siempre es igual o inferior a la energía umbral del mismo sistema termodinámico. La energía umbral, por otro lado, es la energía mínima que debe tener un par de partículas para someterse a una colisión exitosa. Describe la energía requerida por los reactivos para chocar entre sí con éxito para formar el complejo activado. Además de eso, el valor de esta energía siempre es igual o mayor que la energía de activación del mismo sistema termodinámico. La siguiente infografía presenta la diferencia entre la energía de activación y la energía umbral en forma tabular.
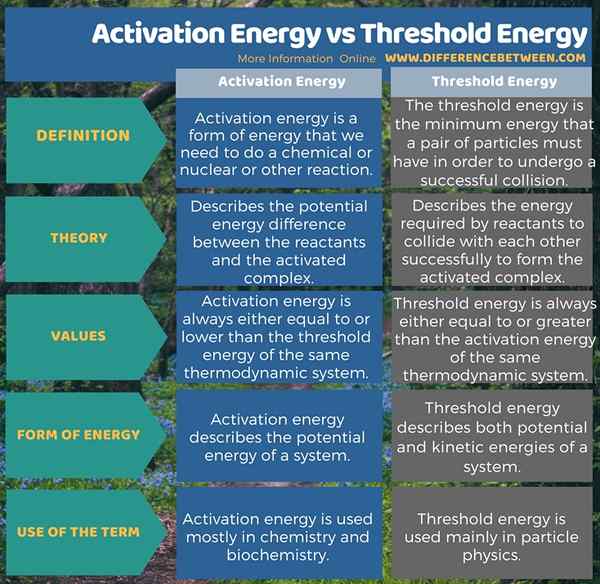
Resumen -Energía de activación versus energía umbral
Podemos definir tanto la energía umbral como la energía de activación para un sistema termodinámico. La diferencia clave entre la energía de activación y la energía umbral es que la energía de activación describe la diferencia de energía potencial entre los reactivos y el complejo activado, mientras que la energía umbral describe la energía requerida por los reactivos para colisionar entre sí para formar con éxito el complejo activado.
Referencia:
1. "Energía de activación."Wikipedia, Fundación Wikimedia, 27 de julio de 2018. Disponible aquí
2. "Energía umbral."Wikipedia, Fundación Wikimedia, 9 de agosto. 2018. Disponible aquí
Imagen de cortesía:
1."Energía de activación" (dominio público) a través de Commons Wikimedia


