Diferencia entre electrodos activos e inertes
Diferencia de clave: electrodos activos vs inertes
Una célula electroquímica está compuesta por dos conductores eléctricos que se llaman electrodos y un conductor iónico que se llama electrolito. Los electrodos transportan carga eléctrica a través de electrones, mientras que los electrolitos realizan su carga a través de iones. Un electrodo es un metal cuya superficie toca el electrolito. El electrolito es un componente no metálico que puede ser una solución o un vacío. Los compuestos iónicos no pueden realizar electricidad en su forma sólida. Por lo tanto, deben estar en forma líquida para realizar electricidad. Estas formas líquidas son los electrolitos que se mencionaron anteriormente. De los dos electrodos, uno actúa como el cátodo (cargado negativamente) y otros actos como el ánodo (cargado positivamente). Los electrodos son principalmente de dos tipos, a saber, electrodos activos y electrodos inertes. La diferencia clave entre el electrodo activo y el electrodo inerte es que El electrodo activo participa en la reacción química mientras que yoEl electrodo nert no participa ni interfiere con la reacción química.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los electrodos activos?
3. ¿Qué son los electrodos inertes?
4. Comparación de lado a lado: electrodos activos vs inertes
5. Resumen
¿Qué es un electrodo activo??
El electrodo activo es un metal que se usa en células electroquímicas. Participa en reacciones que ocurren en el electrolito para transportar la electricidad. El electrodo activo se puede oxidar o reducir. Los electrodos activos se utilizan principalmente en la electroplatación. La electroplatación es el proceso donde se aplica un metal sobre otro metal con el uso de una celda electroquímica. Allí, el electrodo activo actúa como el ánodo que proporciona los cationes a la solución electrolítica. Entonces los cationes llegarán al cátodo y tomarán electrones disponibles allí. Esto provoca la deposición de iones metálicos en la superficie del cátodo. Por lo tanto, el material que debe ser colocado por este método se utiliza como cátodo. Por ejemplo, una cuchara se puede colocar con plata usando un ánodo de plata y la cuchara como cátodo; El nitrato de plata sería el electrolito.
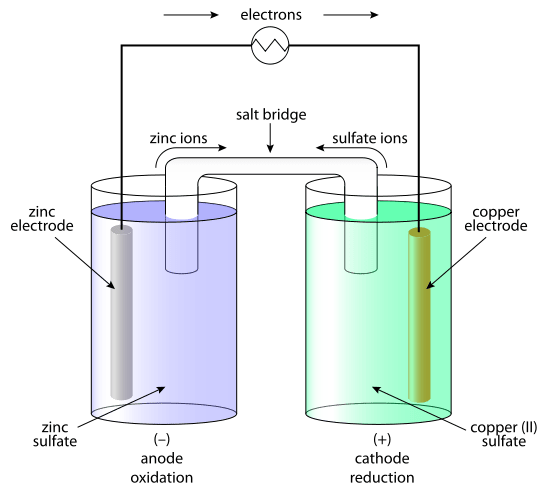
Básicamente, el electrodo activo se llama "activo" porque participa activamente en la reacción química que ocurre en el sistema. Por lo tanto, intercambia activamente iones con una solución electrolítica. Un electrodo activo más utilizado es el electrodo de cobre.

Figura 01: El electrodo de cobre es un ejemplo de un electrodo activo.
¿Qué es un electrodo inerte??
El electrodo inerte es un metal que no participa o interfiere en ninguna reacción química. Pero todavía se usa para realizar electricidad transfiriendo electrones con la solución en lugar de intercambiar iones con la solución. Por lo tanto, sirve como un electrón. El platino se usa como electrodo inerte. Pero el grafito se usa ampliamente porque es barato. El electrodo inerte puede suministrar o retirar electrones en el proceso de realizar electricidad. Los electrodos inertes siempre se usan en la electrólisis, el proceso que separa un compuesto iónico en sus elementos. Por ejemplo, la electrólisis de la solución de cloruro de sodio produce sodio y cloro por separado.
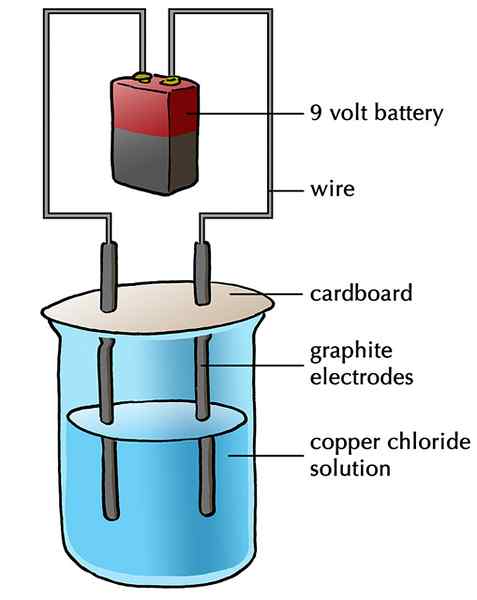
Figura 02: El electrodo de grafito es un ejemplo de un electrodo inerte.
¿Cuál es la diferencia entre electrodos activos e inertes??
Electrodos activos vs inertes | |
| El electrodo activo es el electrodo que participa activamente en la reacción química de la célula electroquímica. | El electrodo inerte es un electrodo que no participa en la reacción química. |
| Usos | |
| Los electrodos activos se utilizan en la electroplatación | Los electrodos inertes se utilizan en electrólisis. |
| Comportamiento | |
| Los iones metálicos del electrodo activo se disuelven en la solución electrolítica | Los iones metálicos del electrodo inerte no se disuelven. |
| Reacciones | |
| Las reacciones de oxidación o reducción pueden ocurrir en el electrodo activo | Las reacciones de oxidación o reducción no ocurren. |
| Modo de conductancia eléctrica | |
| Los electrodos activos realizan electricidad a través del intercambio de iones | Los electrodos inertes realizan electricidad a través de la transferencia de electrones. |
Resumen: electrodos activos vs inertes
Las células electroquímicas son capaces de generar energía eléctrica o facilitar la electricidad al participar en reacciones químicas. Los componentes básicos de una célula electroquímica son dos electrodos y un electrolito. Dos electrodos se nombran como ánodo y cátodo de acuerdo con su comportamiento. Los electrodos activos e inertes son los dos tipos de electrodos. La diferencia clave entre el electrodo activo e inerte es que el electrodo activo participa en la reacción química, mientras que el electrodo inerte no participa ni interfiere con la reacción química.
Referencias:
1. Mittal, V., 2015. Bibliotecas. [En línea] disponible en: https: // chem.bibliotecas.org/Core/Analytical_Chemistry/Electrochemistry/Electrolytic_cells/Electroplating#Title [Consultado 26 05 2017].
2.Chang, R., 2010. química. 10ª ed. Newyork: McGraw-Hill.
Imagen de cortesía:
1."Célula galvánica marcada" por HazMat2 - Trabajo propio (CC por 3.0) a través de Commons Wikimedia
2. "Electrólisis de la solución de cloruro de cobre" por Siyavula Education (CC por 2.0) a través de Flickr


