Diferencia entre la adhesión y la cohesión

El diferencia clave entre la adhesión y la cohesión es que La adhesión es la atracción entre sustancias o moléculas que no son similares, mientras que la cohesión es la atracción entre las moléculas o sustancias que son similares.
Hay varios fenómenos para explicar las cosas que observamos en nuestra vida diaria. Aunque a veces no nos enfocamos en estos pequeños detalles, ellos son los que ayudan a mantener la vida en la tierra. La adhesión y la cohesión son dos de estos fenómenos. Aunque suenan similares, son términos completamente diferentes.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la adhesión?
3. ¿Qué es la cohesión?
4. Comparación de lado a lado: adhesión vs cohesión en forma tabular
5. Resumen
¿Qué es la adhesión??
La adhesión es la fuerza atractiva entre dos tipos de moléculas, que son diferentes entre sí. Por ejemplo, la atracción entre las moléculas de agua con las paredes de los vasos de xilema es la adhesión. Debido a esta fuerza, el agua puede viajar a través del xilema en las plantas. Además, estas son fuerzas intermoleculares.
Hay cinco mecanismos para explicar el mecanismo de adhesión como siguientes:
- Adhesión mecánica
- Adhesión química
- Adhesión dispersiva
- Adhesión electrostática
- Adhesión difusiva
En la adhesión mecánica, el material adhesivo sostiene la superficie llenando en los agujeros o poros en él. En la adhesión química, se forman enlaces químicos, y pueden ser un enlace iónico o covalente. Si los enlaces son iónicos, los electrones pueden donar o atraer, o el intercambio de electrones puede presentarse en la unión covalente.
Aparte de estos, los enlaces intermoleculares como los enlaces de hidrógeno pueden participar en la mantenimiento de dos materiales juntos. Si los dos materiales se mantienen unidos debido a las fuerzas de van der Waals, entonces podemos explicar ese mecanismo por adhesión dispersiva.
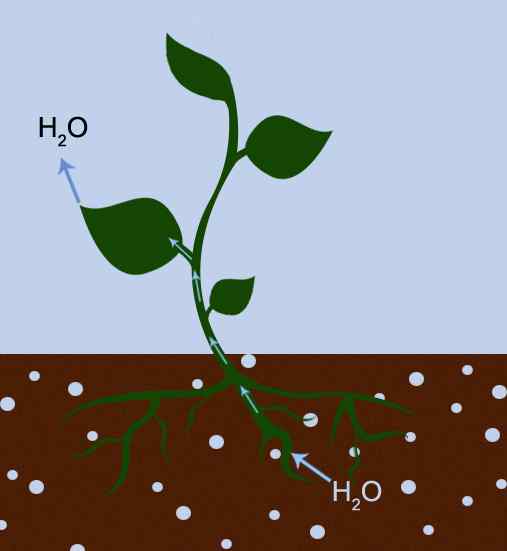
Figura 01: La transpiración se debe tanto a la adhesión como a la cohesión
Además, cuando hay una ligera separación de carga (permanente o temporal) en una molécula, decimos que la molécula se ha polarizado. Las cargas opuestas tienden a atraer entre sí; Por lo tanto, hay fuerzas atractivas entre las moléculas. Un electrón que pasa en material conductor puede causar diferencias de carga eléctrica. Las diferencias de carga pueden causar fuerzas electrostáticas atractivas entre los materiales. Lo llamamos adhesión electrostática.
Cuando dos tipos de moléculas son solubles entre sí, pueden moverse hacia la otra superficie; Por lo tanto, resulta en una adhesión difusiva. La resistencia de las fuerzas de adhesión depende del mecanismo; En cuanto a cómo sucede. Por ejemplo, si el área de superficie de contacto es muy mayor, la resistencia de las fuerzas de van der Waals es mayor. Por lo tanto, la resistencia de las fuerzas de adhesión dispersiva es mayor.
¿Qué es la cohesión??
La cohesión es la fuerza intermolecular entre dos moléculas similares. Por ejemplo, las moléculas de agua tienen fuerzas de atracción intermoleculares entre ellas. Esta propiedad del agua permite que las moléculas de agua viajen con consistencia. Podemos explicar la forma de las gotas de lluvia o la existencia de gotas de agua en lugar de moléculas individuales por la cohesión.

Figura 02: Formación de gotas de agua debido a la cohesión
Además, la capacidad de enlace de hidrógeno de las moléculas de agua es la razón principal detrás de las fuerzas de cohesión de las moléculas de agua. Cada molécula de agua puede formar cuatro enlaces de hidrógeno con otras moléculas de agua; Por lo tanto, la colección de fuerzas de atracción es mucho más fuerte. Las fuerzas electrostáticas y las fuerzas de van der Waals entre moléculas similares también causan adhesión. Sin embargo, la adhesión debido a las fuerzas de van der Waals es algo más débil.
¿Cuál es la diferencia entre adhesión y cohesión??
La adhesión es la fuerza atractiva entre dos tipos de moléculas, que son diferentes entre sí y la cohesión es la fuerza intermolecular entre dos moléculas similares. Por lo tanto, la diferencia clave entre la adhesión y la cohesión es que la adhesión es la atracción entre sustancias o moléculas que no son similares, mientras que la cohesión es la atracción entre las moléculas o sustancias que son similares.
Además, otra diferencia significativa entre la adhesión y la cohesión es que la adhesión incluye atracciones electrostáticas, mientras que la cohesión incluye las fuerzas de Van der Waal y la unión de hidrógeno. Por ejemplo, la cohesión es entre dos moléculas de agua y la adhesión es entre las moléculas de agua y las paredes de los vasos de xilema.

Resumen -Adhesión vs cohesión
La adhesión y la cohesión son dos tipos de fuerzas intramoleculares. La diferencia clave entre la adhesión y la cohesión es que la adhesión es la atracción entre las moléculas de sustancias que no son similares, mientras que la cohesión es la atracción entre las moléculas o sustancias que son similares.
Referencia:
1. Bibliotecas. "Fuerzas cohesivas y adhesivas."Bibliotecas de química, National Science Foundation, 26 de noviembre. 2018. Disponible aquí
Imagen de cortesía:
1."9897320755" por Zappys Technology Solutions (CC por 2.0) a través de Flickr
2."Drops I" por Staffan Enbom de Finlandia (CC por 2.0) a través de Commons Wikimedia


