Diferencia entre los procesos adiabáticos e isentrópicos
El diferencia clave entre los procesos adiabáticos e isentrópicos es que aLos procesos diabáticos pueden ser reversibles o irreversibles, mientras que un proceso isentrópico es un proceso reversible.
En química, dividimos el universo en dos partes. La parte que nos interesa es un sistema, y el resto es el entorno. Un sistema puede ser un organismo, un recipiente de reacción o incluso una sola célula. Podemos distinguir los sistemas por el tipo de interacciones que tienen o por los tipos de intercambios que tienen lugar. A veces, la materia y el intercambio de energía a través de los límites del sistema. La energía intercambiada puede tomar varias formas, como energía de la luz, energía térmica, energía sonora, etc. Si la energía de un sistema cambia debido a una diferencia de temperatura, decimos que ha habido un flujo de calor. Sin embargo, algunos procesos implican variaciones de temperatura pero no hay flujo de calor; Estos se conocen como procesos adiabáticos. Un proceso isentrópico es un tipo de proceso adiabático.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los procesos adiabáticos?
3. ¿Cuáles son los procesos isentrópicos?
4. Comparación de lado a lado - Adiabatic vs isentrópico procesos en forma tabular
5. Resumen
¿Qué son los procesos adiabáticos??
El cambio adiabático es un cambio en el que no se transfiere el calor o fuera del sistema. La transferencia de calor se puede detener principalmente de dos maneras. Uno es mediante el uso de un límite aislado térmicamente para que no pueda ingresar o salir de calor. Por ejemplo, una reacción que ocurre en un matraz de dewar es adiabática. El otro método que puede tener lugar un proceso adiabático es cuando un proceso tiene lugar muy rápidamente; Por lo tanto, no queda tiempo para transferir el calor dentro y fuera.
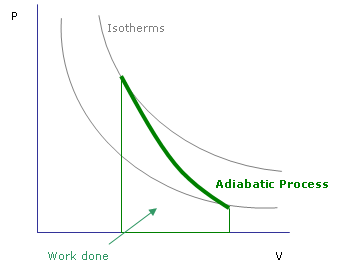
En termodinámica, mostramos los cambios adiabáticos por DQ = 0. En estos casos, existe una relación entre la presión y la temperatura. Por lo tanto, el sistema sufre cambios debido a la presión en condiciones adiabáticas. Esto es lo que sucede en la formación de nubes y las corrientes de convección a gran escala. A altitudes más altas, hay una presión atmosférica más baja. Cuando el aire se calienta, tiende a subir. Debido a que la presión del aire exterior es baja, la parcela de aire ascendente intentará expandirse. Al expandirse, las moléculas de aire funcionan, y esto afectará su temperatura. Es por eso que la temperatura se reduce cuando se levanta.

Figura 01: proceso adiabático en un gráfico
Según la termodinámica, la energía en el paquete permanece constante, pero se puede convertir para hacer el trabajo de expansión o mantener su temperatura. No hay intercambio de calor con el exterior. Este mismo fenómeno se aplica a la compresión del aire también (e.gramo., un pistón). En esa situación, cuando la parcela de aire se comprime, la temperatura aumenta. Estos procesos se denominan calefacción y enfriamiento adiabáticos.
¿Cuáles son los procesos isentrópicos??
Los procesos espontáneos aumentan la entropía del universo. Cuando esto sucede, la entropía del sistema o la entropía circundante pueden aumentar. Un proceso isentrópico ocurre cuando la entropía del sistema permanece constante.
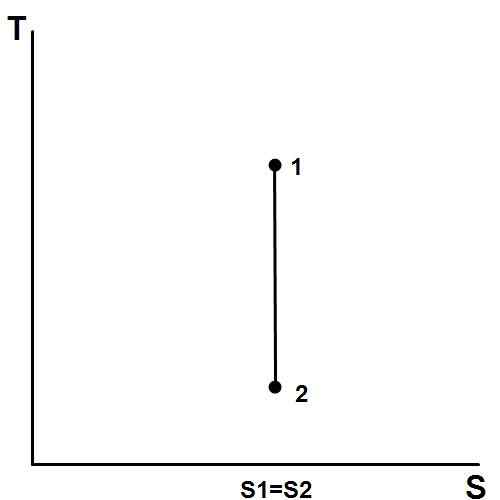
Figura 02: un proceso isentrópico
Un proceso adiabático reversible es un ejemplo de un proceso isentrópico. Además, los parámetros constantes en un proceso isentrópico son la entropía, el equilibrio y la energía térmica.
¿Cuál es la diferencia entre los procesos adiabáticos e isentrópicos??
Un proceso adiabático es un proceso en el que no se realiza una transferencia de calor, mientras que un proceso isentrópico es un proceso termodinámico idealizado que es adiabático y reversible. Por lo tanto, la diferencia clave entre los procesos adiabáticos e isentrópicos es que los procesos adiabáticos pueden ser reversibles o irreversibles, mientras que los procesos isentrópicos son reversibles. Además, se produce un proceso adiabático sin ninguna transferencia de calor entre el sistema y los alrededores, mientras que se produce un proceso isentrópico sin irreversibilidad y sin transferencias de calor.

Resumen -Adiabatic vs isentrópico procesos
Un proceso adiabático es un proceso en el que no se realiza una transferencia de calor. Un proceso isentrópico es un proceso termodinámico idealizado que es adiabático y reversible. Por lo tanto, la diferencia clave entre los procesos adiabáticos e isentrópicos es que los procesos adiabáticos pueden ser reversibles o irreversibles, mientras que los procesos isentrópicos son reversibles.
Referencia:
1. "Las leyes de la termodinámica i." Termodinámica y mecánica estadística introductoria, 2005, PP. 14-31., doi: 10.1002/047168175X.CH3.
Imagen de cortesía:
1. "Adiabatic" (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Isentrópico" de Tyler.Nysmith - Trabajo propio (CC By -SA 3.0) a través de Commons Wikimedia


