Diferencia entre afinidad y avidez
Diferencia clave: afinidad vs avidez
El anticuerpo La interacción antígeno es una interacción crucial en las células para reaccionar contra las infecciones. Los antígenos son las partículas extrañas que ingresan a las células huésped. Están compuestos principalmente de polisacáridos o glucoproteínas y tienen formas particulares. La interacción entre el antígeno y el anticuerpo ocurre de acuerdo con la unión correcta de las dos partes por los enlaces no covalentes, como los enlaces de hidrógeno, enlaces de van der Waals, etc. Esta interacción es reversible. La afinidad y la avidez son dos parámetros que miden la resistencia de la interacción antígeno-anticuerpo en inmunología. La diferencia clave entre afinidad y avidez es que La afinidad es la medida de la resistencia de la interacción individual entre un epítopo y un sitio de unión del anticuerpo, mientras que la avidez es la medida de las uniones generales entre los determinantes antigénicos y los sitios de unión al antígeno del anticuerpo multivalente. La afinidad es un factor que influye en la avidez de la interacción de anticuerpos antígeno.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es afinidad
3. Que es la avidez
4. Comparación de lado a lado: afinidad vs avidez
5. Resumen
Que es afinidad?
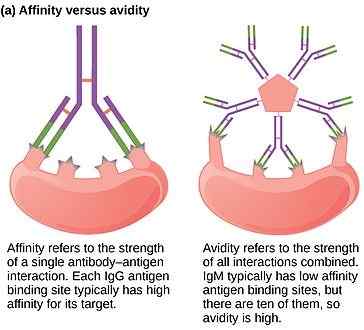
La afinidad es una medida de la interacción entre un sitio de unión al antígeno del anticuerpo y un epítopo del antígeno. El valor de afinidad refleja el resultado neto de las fuerzas atractivas y repulsivas entre el epítopo individual y el sitio de unión individual. El valor de alto afinidad es el resultado de una fuerte interacción con fuerzas más atractivas entre el epítopo y el sitio de unión a AB. El valor de bajo afinidad indica el bajo equilibrio entre fuerzas atractivas y repulsivas.
La afinidad de los anticuerpos monoclonales se puede medir fácilmente ya que tienen un solo epítopo y son homogéneos. Los anticuerpos policlonales califican un valor de afinidad promedio debido a su naturaleza heterogénea y sus diferencias en las afinidades hacia los diferentes epítopos antigénicos.
El ensayo inmunosorbente ligado a enzimas (ELISA) es una nueva técnica en farmacología que se utiliza para medir la afinidad de los anticuerpos. Resulta en datos más precisos, convenientes e informativos para la determinación de afinidad. Los anticuerpos de alta afinidad se unen con el epítopo rápidamente y hacen un fuerte vínculo que persiste durante los ensayos inmunológicos, mientras que los anticuerpos de baja afinidad disuelven la interacción y no son detectados por los ensayos.
Que es la avidez?
La avidez de un anticuerpo es una medida de la resistencia general de la unión entre los antígenos y el anticuerpo. Depende de varios factores, como la afinidad del anticuerpo hacia el antígeno, la valencia del antígeno y el anticuerpo y la disposición estructural de la interacción. Si el anticuerpo y el antígeno son multivalentes y tienen una disposición estructural favorable, la interacción sigue siendo muy fuerte debido a la alta avidez. La avidez siempre muestra un valor alto que la suma de las afinidades individuales.
La mayoría de los antígenos son multiméricos y la mayoría de los anticuerpos son multivalencia. Por lo tanto, la mayoría de las interacciones de anticuerpos antígeno siguen siendo fuertes y estables debido a la alta avidez del complejo de antígeno-anticuerpo.

Figura 01: Afinidad y avidez de un anticuerpo
¿Cuál es la diferencia entre afinidad y avidez??
Afinidad vs avidez | |
| La afinidad se refiere a la fuerza de la interacción entre un epítopo antigénico con un sitio de unión al antígeno del anticuerpo. | La avidez es la medida de la fuerza general de la interacción entre los epítopos antigénicos con anticuerpo multivalencia. |
| Ocurrencia | |
| Esto ocurre entre el epítopo individual y el sitio de enlace individual | Esto ocurre entre antígenos y anticuerpos multivalentes. |
| Valor | |
| La afinidad es el equilibrio de fuerzas atractivas y repulsivas. | La avidez puede considerarse como un valor más que la suma de las afinidades individuales. |
Resumen -Affinity vs Avidez
La interacción con anticuerpos antígeno es una interacción específica, reversible y no covalente importante en los estudios inmunológicos. Es similar a la interacción del sustrato enzimático. El antígeno específico se une con un anticuerpo específico. La afinidad y la avidez son dos medidas de esta interacción. La afinidad refleja la fuerza de una interacción entre un epítopo y un sitio de unión al antígeno del anticuerpo. La avidez refleja la fuerza general del complejo de anticuerpos antígeno. Esta es la diferencia entre afinidad y avidez. La avidez es el resultado de múltiples afinidades que ocurren en un complejo de anticuerpos antígeno, ya que la mayoría de los antígenos y anticuerpos son multivalentes y mantienen varias interacciones para estabilizar la unión.
Referencias:
1. Rudnick, Stephen I., y Gregory P. Adams. "Afinidad y avidez en la orientación de tumores basados en anticuerpos."Bioterapia contra el cáncer y radiofarmacéuticos. Mary Ann Liebert, Inc., Abr. 2009. Web. 21 mar. 2017
2. Sennhauser, F. H., Riñonal. A. MacDonald, D. METRO. Roberton y C. S. Engaño. "Comparación de la concentración y la avidez de anticuerpos específicos con E. coli en leche materna y suero."Inmunología. U.S. Biblioteca Nacional de Medicina, Mar. 1989. Web. 22 mar. 2017
Imagen de cortesía:
1. "Figura 42 03 04" por CNX OpenStax - (CC por 4.0) a través de Commons Wikimedia


