Diferencia entre alcanos y alquenos
Diferencia clave - Alcanos vs Alcenes
Los alcanos y los alquenos son dos tipos de familias de hidrocarburos que contienen carbono e hidrógeno en su estructura molecular. La diferencia clave entre alcanos y alquenos es su estructura química; Los alcanos son hidrocarburos saturados con la fórmula molecular general de CnorteH2n+2 y se dice que los alquenos son un grupo de hidrocarburos insaturados ya que contienen un doble enlace entre dos átomos de carbono. Tienen la fórmula molecular general de CnorteH2n.
¿Qué son los alcanos??
Los alcanos contienen solo enlaces individuales entre los átomos de carbono e hidrógeno (enlaces C-C y enlaces C-H). Por lo tanto, se denominan "hidrocarburos saturados". Según el modelo de hibridación orbital, todos los átomos de carbono en los alquenos tienen el SP3 hibridación. Forman enlaces sigma con átomos de hidrógeno, y la molécula resultante tiene la geometría de un tetraedro. Los alcanos se pueden subdividir en dos grupos de acuerdo con sus arreglos moleculares; alcanos acíclicos (cnorteH2n.+2) y alcanos cíclicos (cnorteH2n).
¿Qué son los alquenos??
Los alcenes son los hidrocarburos, que contienen un doble enlace carbono (c = c). "Olefins" ¿Se utiliza el antiguo nombre para referirse a la familia Alkene?. El miembro más pequeño de esta familia es el etano (c2H4); fue llamado olefianoT Gas (en latín: 'oleum ' significa 'aceite' + 'Faceras' significa 'hacer') en los primeros días. Esto se debe a que la reacción entre C2H4 y el cloro da c2H2CL2, aceite.
¿Cuál es la diferencia entre alcanos y alquenos??
Estructura química de álcanes y alquenos
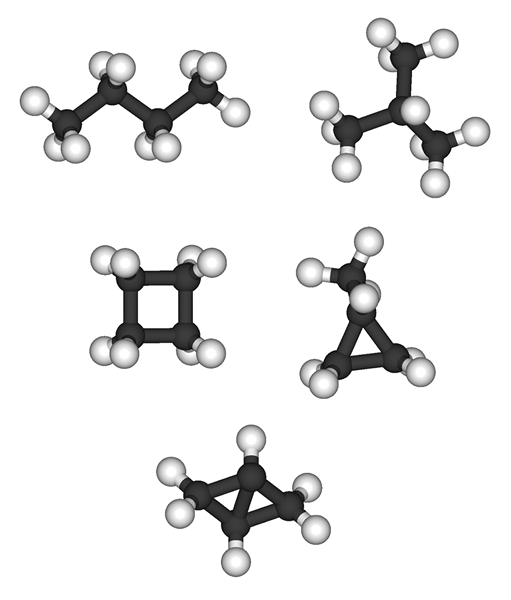
Alkanes: Los alcanos tienen la fórmula molecular general CnorteH2n+2. Metano (CH4) es el Alkane más pequeño.
| Nombre | Fórmula química | Estructura acíclica |
| Metano | Pez4 | Pez4 |
| Etano | C2H6 | Pez3Pez3 |
| Propano | C3H8 | Pez3Pez2Pez3 |
| Butano | C4H10 | Pez3Pez2Pez2Pez3 |
| Pentano | C5H12 | Pez3Pez2Pez2Pez2Pez3 |
| Hexano | C6H14 | Pez3Pez2Pez2 Pez2Pez2Pez3 |
| Heptano | C7Hdieciséis | Pez3Pez2Pez2Pez2Pez2Pez2Pez3 |
| Octano | C8H18 | Pez3 Pez3Pez2Pez2Pez2Pez2Pez3Pez3 |
Alcenes: Los alcenes tienen la fórmula química general de CnorteH2n. Los alcenes se consideran hidrocarburos insaturados ya que no contienen el número máximo de átomos de hidrógeno que pueden ser propiedad de una molécula de hidrocarburos.
| Nombre | Fórmula química | Estructura |
| Eteno | C2H4 | Pez2 = Pez2 |
| Propeno | C3H6 | Pez3CH = CH2 |
| Buteno | C4H8 | Pez2 =Chch2Pez3, Pez3CH = chch3 |
| Penteno | C5H10 | Pez2 =Chch2Pez2Pez3, Pez3CH = chch2Pez3 |
| Hexeno | C6H12 | Pez2 =Chch2 Pez2Pez2Pez3Pez3CH = chch2Pez2Pez3 Pez3Pez2Pez=Chch2Pez3 |
| Hepteno | C7H14 | Pez=Chch2Pez2Pez2Pez2Pez3Pez3CH = CH2Pez2Pez2Pez2Pez3 |
Propiedades químicas de álcanes y alquenos
Alcanos:
Reactividad:
Los alcanos son inertes a muchos reactivos químicos. Esto se debe a que los enlaces de carbono-carbono (C-C) y de carbono-hidrógeno (C-H) son bastante fuertes ya que los átomos de carbono e hidrógeno tienen casi los mismos valores de electronegatividad. Por lo tanto, es muy difícil romper sus lazos, a menos que se calienten a temperaturas bastante altas.
Combustión:
Los alcanos pueden quemarse fácilmente en el aire. La reacción entre alcanos con exceso de oxígeno se llama "combustión". En esta reacción, los alcanos se convierten en dióxido de carbono (CO2) y agua.
CnorteH2n + (n + n/2) o2 → n co2 + Nueva Hampshire2O
C4H10 + 13/2 O2 → 4 Co2 + 5h2O
Agua de dióxido de carbono de oxígeno de butano
Las reacciones de combustión son reacciones exotérmicas (emiten el calor). Como resultado, los alcanos se usan como fuente de energía.
Alcenes:
Reactividad:
Los alcenes reaccionan con hidrógeno en presencia de un catalizador de metal finamente dividido para formar el alcano correspondiente. La velocidad de la reacción es muy baja sin un catalizador.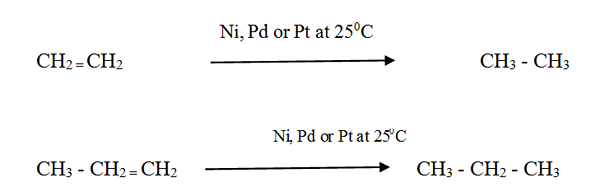
La hidrogenación catalítica se usa en la industria alimentaria para convertir los aceites vegetales líquidos en grasa semisólida para hacer grasa de margarina y cocción sólida.
Propiedades físicas de alcanos y alquenos
Formularios
Alkanes: Los alcanos existen como gases, líquidos y sólidos. Metano, etano, propano y butano son gases a temperatura ambiente. Las estructuras no ramificadas de hexano, pentano y heptano son líquidos. Los alcanos que tienen un peso molecular más alto son sólidos.
Pez4 a c4H10 son gases
C5H12 a c17H36 son líquidos, y
Los alcanos con mayor peso molecular son sólidos blandos
Alcenes: Los alquenos muestran propiedades físicas similares del alcane correspondiente. Alquenos que tienen pesos moleculares más bajos (c2H4 tocarse4H8) son gases a temperatura ambiente y presión atmosférica. Los alquenos que tienen un peso molecular más alto son sólidos.
Solubilidad:
Alkanes: Los alcanos no se disuelven en agua. Se disuelven en solventes orgánicos no polares o débilmente polares.
Alcenes: Los alcenos son moléculas relativamente polares debido al enlace C = C; Por lo tanto, son solubles en solventes o solventes no polares de baja polaridad. El agua es una molécula polar y los alquenos son ligeramente solubles en agua.
Densidad:
Alkanes: Las densidades de los alcanos son más bajas que la densidad del agua. Su valor de densidad es casi 0.7 g ml-1, considerando la densidad del agua como 1.0 g ml-1.
Alcenes: Las densidades de los alquenos son más bajas que la densidad del agua.
Puntos de ebullición:
Alkanes: El punto de ebullición de los alcanos no ramificados aumenta suavemente a medida que el número de átomos de carbono y el peso molecular están aumentando. En general, los alcanos ramificados tienen puntos de ebullición más bajos en comparación con los alcanos no ramificados, con el mismo número de átomos de carbono.
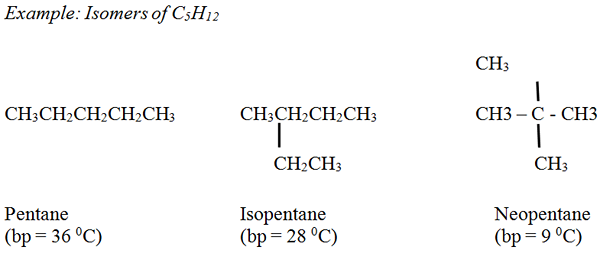
Álcenos: Los puntos de ebullición son similares a los alcanos correspondientes con una pequeña variación.
Referencias: Notas de acantilado. (norte.d.). Consultado el 6 de julio de 2016 desde aquí. Directorio Zum-Modus. (norte.d.). Consultado el 6 de julio de 2016 desde aquí Polaridad. (norte.d.). Consultado el 6 de julio de 2016 desde aquí Momentos dipolo. (2013). Consultado el 6 de julio de 2016 desde aquí Isómero estructural. (norte.d.). Consultado el 6 de julio de 2016 desde aquí Una introducción a los alquenos. (norte.d.). Consultado el 6 de julio de 2016 desde aquí Imagen de cortesía: "Nombres de alquene" de Chris Evans - (CC0) a través de Commons Wikimedia "Hidrocarburos Saturados C4 Bola y palo" por Fvasconcellos-Trabajo propio (dominio público) a través de Commons Wikimedia

