Diferencia entre alotropas e isótopos
El diferencia clave entre alotropas e isótopos es que Los alótropos se consideran a nivel molecular, mientras que los isótopos se consideran a nivel atómico.
Hay alrededor de 118 elementos en la tabla periódica de acuerdo con su número atómico. Un elemento es una sustancia química que consiste en un solo tipo de átomos; Por lo tanto, son puros. Los alótropos son diferentes formas del mismo compuesto, mientras que los isótopos son diferentes formas del mismo elemento.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los alotropos?
3. ¿Qué son los isótopos?
4. Comparación de lado a lado: alotropos vs isótopos en forma tabular
5. Resumen
¿Qué son los alotropos??
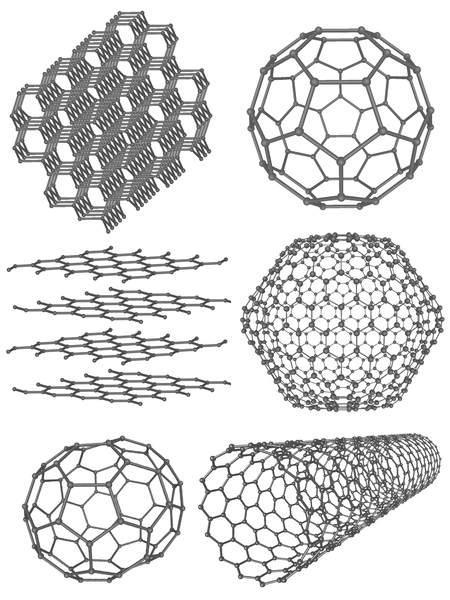
Los alótropos son diferentes formas del mismo elemento en el nivel molecular. Muestran diferentes propiedades físicas. Entre todos los elementos químicos, el carbono, el oxígeno, el azufre y el fósforo se encuentran los principales elementos que tienen alotropas. El carbono tiene una gran cantidad de alotropas. Los ocho alotropos de carbono difieren en gran medida entre sí. Por ejemplo, el diamante es la alotropea más fuerte de carbono, mientras que el grafito es menos fuerte. Los nanotubos de carbono, el fullereno y el carbono amorfo son otros alotropos de carbono.

Figura 1: Altopes de carbono
Para el elemento oxígeno, hay dos alotropas comunes como O2 y O3. O2 es abundante que O3. Normalmente, en la naturaleza, algunos alotropos son más abundantes que otros debido a su estabilidad. El fósforo tiene tres alotropos como fósforo rojo, blanco y negro. De estos, el fósforo rojo y blanco es el más común. Los alotropos difieren entre sí debido a la disposición atómica, el número de átomos, etc.
¿Qué son los isótopos??
Los isótopos son diferentes formas de átomos del mismo elemento químico. Son diferentes entre sí, ya que tienen un número diferente de neutrones. Dado que el número de neutrones es diferente, su número de masa también difiere.
Sin embargo, los isótopos del mismo elemento tienen el mismo número de protones y neutrones. Diferentes isótopos están presentes en cantidades variables, y podemos dar esto como un valor porcentual llamado abundancia relativa. Por ejemplo, el hidrógeno tiene tres isótopos como protio, deuterio y tritio. Su número de neutrones y abundancias relativas son las siguientes.

Figura 2: diferentes isótopos del elemento químico hidrógeno
El número de neutrones que un núcleo puede contener difiere de un elemento a otro. Entre estos isótopos, solo algunos son estables. Por ejemplo, el oxígeno tiene tres isótopos estables, y el estaño tiene diez isótopos estables. La mayoría de las veces, los elementos simples tienen el mismo número de neutrones que el número de protones. Pero, en elementos pesados, hay más neutrones que protones. El número de neutrones es importante para equilibrar la estabilidad de los núcleos. Cuando los núcleos son demasiado pesados, se vuelven inestables; Por lo tanto, esos isótopos se vuelven radiactivos. Por ejemplo, 238U emite radiación y decae a núcleos mucho más pequeños. Los isótopos pueden tener diferentes propiedades debido a sus diferentes masas. Por ejemplo, pueden tener diferentes giros; Así, sus espectros de RMN difieren. Sin embargo, su número de electrones es similar, dando lugar a un comportamiento químico similar.
¿Cuál es la diferencia entre alótropos e isótopos??
Los alótropos son diferentes formas del mismo elemento en el nivel molecular. Los isótopos son diferentes formas de átomos del mismo elemento químico. La diferencia clave entre alotropos e isótopos es que los alotropos se consideran a nivel molecular, mientras que los isótopos se consideran a nivel atómico. Además, una diferencia adicional entre alótropos e isótopos es que los alotropos difieren entre sí en la forma en que se organizan los átomos, mientras que los isótopos difieren entre sí en el número de neutrones.
La siguiente infografía muestra más detalles sobre la diferencia entre alotropas e isótopos.

Resumen -Alotropos vs isótopos
Aunque los términos alotrape e isótopos suenan similares, son muy distintos entre sí de acuerdo con sus significados. La diferencia clave entre alotropos e isótopos es que los alotropos se consideran a nivel molecular, mientras que los isótopos se consideran a nivel atómico.
Referencia:
1. Helmenstine, Anne Marie, “Definición y ejemplos de alotropas."Thinkco, Jan. 13, 2019, disponible aquí.
2. Helmenstine, Anne Marie, “Definición de isótopos y ejemplos en química."Thinkco, octubre. 22, 2018, disponible aquí.
Imagen de cortesía:
1. "Altopes of Carbon” de Mstroeck (Talk) (Subidas) - Trabajo propio (CC By -SA 3.0) a través de Commons Wikimedia


