Diferencia entre Alpha Helix y Beta Pleated Sheet
Diferencia de clave: Alpha Helix vs Beta Pleated Sheet
Las hélices alfa y las hojas beta plisadas son las dos estructuras secundarias más comúnmente encontradas en una cadena de polipéptidos. Estos dos componentes estructurales son los primeros pasos principales en el proceso de plegar una cadena de polipéptidos. El diferencia clave Entre Alpha Helix y la hoja plisada beta está en su estructura; Tienen dos formas diferentes para hacer un trabajo específico.
¿Qué es Alpha Helix??
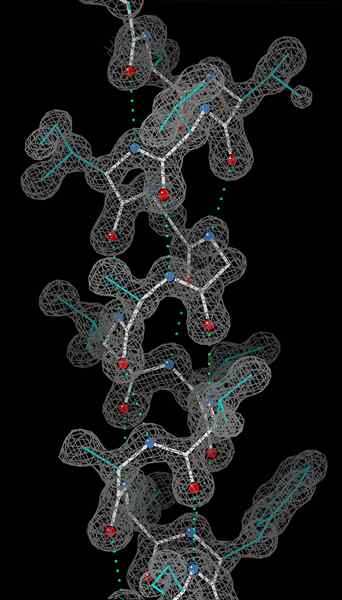
Una hélice alfa es una bobina diestra de residuos de aminoácidos en una cadena de polipéptidos. El rango de residuos de aminoácidos puede variar de 4 a 40 residuos. Los enlaces de hidrógeno formados entre el oxígeno del grupo C = O en la bobina superior y el hidrógeno del grupo N-H de la bobina inferior ayudan a mantener la bobina unida. Se forma un enlace de hidrógeno por cada cuatro residuos de aminoácidos en la cadena de la manera anterior. Este patrón uniforme le da características definitivas como el grosor de la bobina y dicta la longitud de cada giro completo a lo largo del eje de hélice. La estabilidad de la estructura de la hélice alfa depende de varios factores.

O átomos en rojo, átomos de N en azul y enlaces de hidrógeno como líneas punteadas verdes
¿Qué es la hoja plisada beta??
La hoja plisada beta, también conocida como hoja beta, se considera la segunda forma de estructura secundaria en proteínas. Contiene hilos beta que están conectados lateralmente por un mínimo de dos o tres enlaces de hidrógeno columnas para formar una hoja retorcida y plisada como se muestra en la imagen. Un hilo beta es un tramo de cadena de polipéptidos; Su longitud es generalmente igual a 3 a 10 aminoácidos, incluida la columna vertebral en una confirmación extendida.
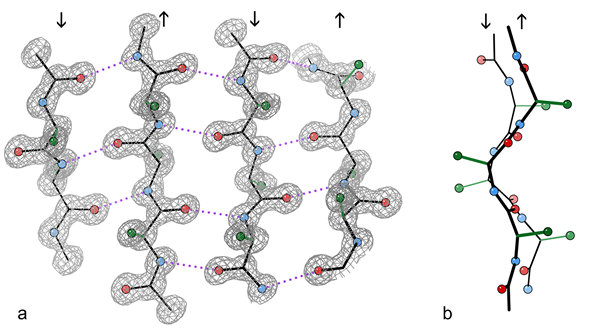
Fragmento de lámina β antiparalela de 4 cadenas de una estructura cristalina de la enzima catalasa.
a) Mostrar los enlaces de hidrógeno antiparalelo (punteado) entre los grupos péptidos NH y CO en hebras adyacentes. Las flechas indican la dirección de la cadena, y los contornos de densidad de electrones delinean los átomos no H-H. Los átomos o son bolas rojas, los átomos de N son azules y los átomos de H se omiten por simplicidad; Las tecnologías laterales se muestran solo al primer átomo Sidechain C (verde)
b) Vista de borde de los dos hilos β centrales
En las hojas plisadas beta, las cadenas de polipéptidos corren una vez al otro. Obtiene el nombre "Hoja plisada" debido a la apariencia de la estructura en forma de onda. Están unidos juntos por enlaces de hidrógeno. Esta estructura permite formar más enlaces de hidrógeno estirando la cadena de polipéptidos.
¿Cuál es la diferencia entre Alpha Helix y la hoja plisada??
Estructura de la hoja alfa hélice y beta plisada
Alpha Helix:
En esta estructura, la columna vertebral del polipéptido está estrechamente unido alrededor de un eje imaginario como estructura espiral. También se conoce como la disposición helicoidal de la cadena de péptidos.
La formación de la estructura de la hélice alfa ocurre cuando las cadenas de polipéptidos se torcen en una espiral. Esto permite que todos los aminoácidos en la cadena formen enlaces de hidrógeno (un enlace entre una molécula de oxígeno y una molécula de hidrógeno) entre sí. Los enlaces de hidrógeno permiten que la hélice sostenga la forma espiral y proporciona una bobina apretada. Esta forma espiral hace que la hélice alfa sea muy fuerte.
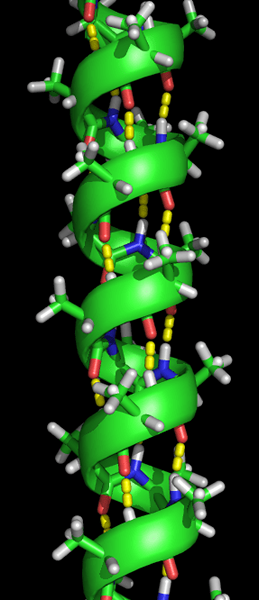
Los enlaces de hidrógeno están indicados por los puntos amarillos.
Hoja beta plisada:
Cuando dos o más fragmentos de cadena (s) de polipéptidos se superponen entre sí, formando una fila de enlaces de hidrógeno entre sí, se pueden encontrar las siguientes estructuras. Puede suceder de dos maneras; disposición paralela y disposición antiparalela.
Ejemplos de la estructura:
Alpha Helix: Las uñas o las uñas de los pies se pueden tomar como un ejemplo de una estructura de hélice alfa.
Hoja beta plisada: La estructura de las plumas es similar a la estructura de la hoja plisada beta.
Características de la estructura:
Alpha Helix: En la estructura de la hélice alfa, hay 3.6 aminoácidos por turno de la hélice. Todos los enlaces peptídicos son trans y planos, y los grupos N-H en los enlaces de péptidos apuntan en la misma dirección, que es aproximadamente paralelo al eje de la hélice. Los grupos C = O de todos los enlaces peptídicos apuntan en la dirección opuesta, y son paralelos al eje de la hélice. El grupo C = O de cada enlace péptido se une al grupo N-H del enlace péptido que forma un enlace de hidrógeno. Todos los grupos r están apuntando hacia afuera desde la hélice.
Hoja beta plisada: Cada enlace peptídico en la hoja plisada beta es plana y tiene la transformación trans. Los grupos C = O y N-H de enlaces peptídicos de las cadenas adyacentes están en el mismo plano y apuntan entre sí formando un enlace de hidrógeno entre ellos. Todos los grupos R en cualquier cadena pueden ocurrir alternativamente por encima y por debajo del plano de la hoja.
Definiciones:
Estructura secundaria: es la forma de una proteína plegable debido a la unión de hidrógeno entre sus grupos de amida y carbonilo.
Referencias: "Estructura de proteínas". Chemwiki: la química dinámica hipertexto "Estructura secundaria de proteínas: hélices α y hojas β" . Proteincructuras.com por Salam Al Karadaghi "Química orgánica". El libro de texto de la celda virtual "Hoja beta".Imagen de Wikipedia Cortesía: "Helix Electron Density Mioglobin 2Nrl 17-32" por DCRJSR - Trabajo propio (CC por 3.0) a través de Commons Wikimedia "Estructura secundaria de proteínas" por EN: Usuario: Bikadi (CC BY-SA 3.0) a través de Commons Wikimedia "Hoja de beta de antipar 1gwe ambos" por DCRJSR - Trabajo propio (CC por 3.0) a través de Commons Wikimedia

