Diferencia entre el nitrato de amonio y el sulfato de amonio
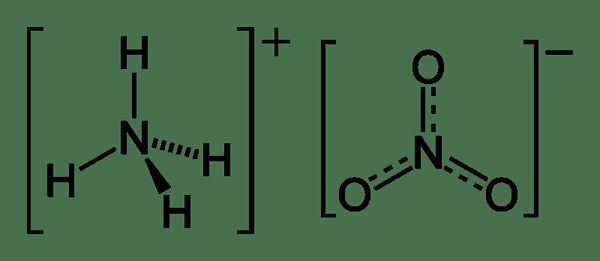
El diferencia clave entre el nitrato de amonio y el sulfato de amonio es que El nitrato de amonio es el resultado de una reacción entre el amoníaco y el ácido nítrico, mientras que el sulfato de amonio se produce cuando el amoníaco reacciona con ácido sulfúrico. Además, considerando su aplicación principal como fertilizante, el nitrato de amonio se adapta mejor a los suelos ácidos, mientras que el sulfato de amonio se adapta mejor a los suelos alcalinos.
El nitrato de amonio y el sulfato de amonio son dos sales de amoníaco que son útiles para diversos fines. Además, el nitrato de amonio también es útil como ingrediente en los explosivos, pero su uso principal es la agricultura como fertilizante. El sulfato de amonio también es una sal inorgánica de amoníaco. Es importante como fertilizante para el suelo. Veamos la diferencia entre las dos sales.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el nitrato de amonio?
3. ¿Qué es el sulfato de amonio?
4. Comparación de lado a lado: nitrato de amonio frente a sulfato de amonio en forma tabular
6. Resumen
¿Qué es el nitrato de amonio??
El nitrato de amonio es una sal inorgánica que contiene un anión de nitrato vinculado a un catión de amonio. Por lo tanto, podemos nombrarlo como una sal de nitrato de catión de amonio. La fórmula química para este compuesto es NH4NO3. Este compuesto existe como un sólido de cristal blanco que es muy soluble en agua. Lo usamos principalmente para fines agrícolas como fertilizante rico en nitrógeno. Otra aplicación importante es su uso en la producción de explosivos.
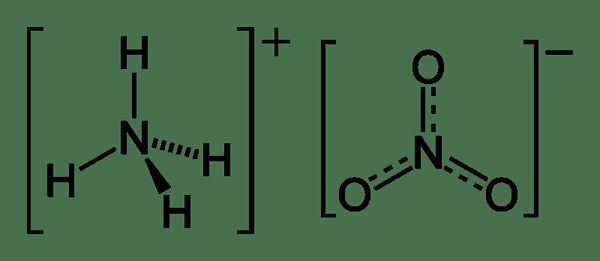
Figura O1: Estructura química del nitrato de amonio
La masa molar de este compuesto es 80.043 g/mol. Aparece como un sólido de color gris blanco. El punto de fusión de este compuesto es 169.6 ° C, por lo tanto, se descompone por encima de 210 ° C. La disolución de este compuesto en agua es endotérmica. Al considerar la ocurrencia, ocurre como un mineral natural a menudo en combinación con los minerales de haluro. En el proceso de producción industrial, podemos usar una reacción ácida-base entre amoníaco y ácido nítrico para producir nitrato de amonio. Allí deberíamos usar amoníaco en su forma anhidra y ácido nítrico en su forma concentrada.
¿Qué es el sulfato de amonio??
El sulfato de amonio es un compuesto inorgánico que contiene un catión de amonio vinculado con un anión sulfato. La fórmula química de este compuesto es (NH4)2ENTONCES4. Por lo tanto, tiene dos cationes de amonio por un anión de sulfato. Es una sal inorgánica de sulfato con muchos usos importantes.
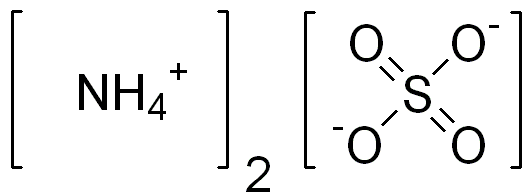
Figura O2: Estructura química del sulfato de amonio
Su masa molar es 132.14 g/mol; Por lo tanto, aparece como gránulos o cristales higroscópicos finos. Además, el punto de fusión varía de 235 a 280 ° C y por encima de este rango de temperatura, el compuesto se descompone. Podemos producir este compuesto mediante el tratamiento del amoníaco con ácido sulfúrico. En esto usamos una mezcla de gas amoníaco y vapor de agua en un reactor. Podemos agregar ácido sulfúrico concentrado en este reactor. La reacción entre estos componentes formará sulfato de amonio.
Al considerar los usos de este compuesto, podemos usarlo como fertilizante principalmente para suelos alcalinos. Además, podemos usarlo en la producción de insecticidas, herbicidas, fungicidas, etc. Además, utilizamos este compuesto para la purificación de proteína mediante precipitación en el laboratorio de bioquímica. También usamos esto como aditivo alimentario.
¿Cuál es la diferencia entre el nitrato de amonio y el sulfato de amonio??
Mientras que el nitrato de amonio es el resultado de una reacción entre el amoníaco y el ácido nítrico, el sulfato de amonio se produce cuando el amoniaco reacciona con ácido sulfúrico. Esta es la diferencia clave entre el nitrato de amonio y el sulfato de amonio. A pesar de tener nitrógeno como una sustancia común en ambas sales, tienen diferentes propiedades físicas y químicas.
Debido a las diferencias en sus propiedades, hay alguna diferencia entre el nitrato de amonio y el sulfato de amonio en la aplicación. Los iones de sulfato en el sulfato de amonio funcionan como un estimulante para los suelos alcalinos. Estos iones ayudan a disminuir el valor de pH del suelo, por lo que es ideal para el crecimiento de las plantas. Es por eso que podemos encontrar sulfato de amonio para estar ampliamente en uso en la industria de fertilizantes. El nitrato de amonio también funciona como fertilizante del suelo. Se puede rociar en el suelo como un rocío, o uno puede rociarlo en forma de polvo. Además, se adapta mejor a los suelos ácidos. Por lo tanto, es prudente que revisen la calidad de su suelo antes de finalizar uno de los dos fertilizantes.
Además, el nitrato de amonio también se usa como paquetes fríos, ya que libera energía exotérmica cuando se agrega al agua que hace fría el producto. Además de lo anterior, hay otro uso de nitrato de amonio, y eso es como un ingrediente activo en los explosivos.
La siguiente infografía presenta más detalles sobre la diferencia entre el nitrato de amonio y el sulfato de amonio en forma tabular.
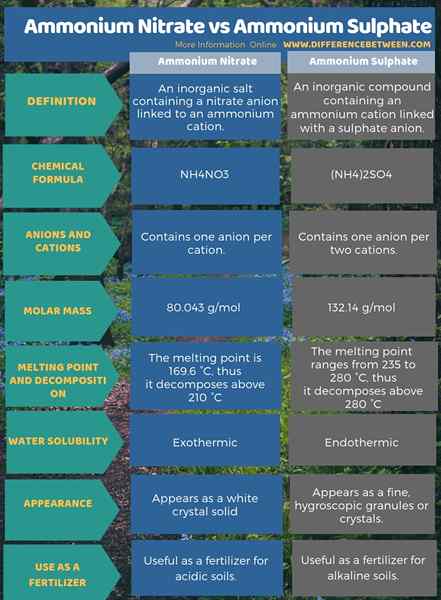
Resumen -nitrato de amonio versus sulfato de amonio
Tanto el nitrato de amonio como el sulfato de amonio son útiles como fertilizantes. La diferencia clave entre el nitrato de amonio y el sulfato de amonio es que el nitrato de amonio es el resultado de una reacción entre el amoníaco y el ácido nítrico, mientras que se produce sulfato de amonio cuando se produce el amoníaco con ácido sulfúrico.
Referencia:
1. "Nitrato de amonio."Wikipedia, Fundación Wikimedia, 9 de septiembre. 2018. Disponible aquí
Imagen de cortesía:
1."Amonio-nitrato-2d" por Ben Mills-Trabajo propio, (dominio público) a través de Commons Wikimedia
2."Sulfato de amonio" de Edgar181 - Trabajo propio, (dominio público) a través de Commons Wikimedia


