Diferencia entre nitrato de amonio y urea

Nitrato de amonio vs urea
Los compuestos que contienen nitrógeno se usan comúnmente como fertilizantes porque el nitrógeno es uno de los elementos altamente esenciales para el crecimiento y el desarrollo de las plantas. El nitrato de amonio y la urea son tales nitrógeno que contienen sólidos.
Nitrato de amonio
El nitrato de amonio tiene la fórmula química de NH4NO3. Este es el nitrato de amoníaco, y tiene la siguiente estructura.
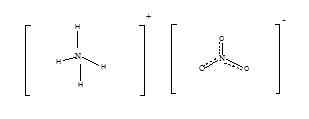
A temperatura ambiente y a presión estándar, existe un sólido cristalino blanco inodoro y inodoro. Esta es una sal ácida con un pH de aproximadamente 5.4. Su masa molar es 80.052 g/mol. El punto de fusión del nitrato de amonio es de aproximadamente 170 ° C y se descompone cuando se calienta a aproximadamente 210 OC. El nitrato de amonio se utiliza principalmente con fines agrícolas. Es rico en nitrógeno, por lo que se usa como fertilizante, para suministrar nitrógeno a las plantas. Dado que su contacto directo con químicos no es peligroso y la toxicidad es menor, es beneficioso usarlo como fertilizante. Además, el calentamiento o la encendido hace que explote el nitrato de amonio. Por lo tanto, se usa como agente oxidante en explosivos. Debido a esta naturaleza explosiva, al almacenar nitrato de amonio debemos tener mucho cuidado. El nitrato de amonio es estable, pero cuando se encuentra en el estado fundido, el riesgo de explosión es mayor. El riesgo aumenta si se trata de contactar con materiales oxidizables como aceite, diesel, papel, trapo o paja. La producción de nitrato de amonio es una reacción química simple. Cuando el ácido nítrico se reacciona con líquido de amoníaco, se produce nitrato de amonio en la forma. Industrialmente, se utilizan gases nítricos concentrados y gas amoníaco para la producción. Dado que esta es una reacción altamente exotérmica y violenta, es un desafío producirlo a gran escala. Siendo una sal, el nitrato de amonio es altamente soluble en agua. Por lo tanto, cuando se usa como fertilizante se puede lavar y acumularse en cuerpos de agua. Esta podría ser una condición fatal para la vida acuática.
Urea
La urea tiene la fórmula molecular de CO (NH2)2 y la siguiente estructura.
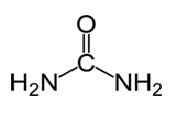
Es una carbamida con el grupo funcional C = O. Dos NH2 Los grupos están unidos al carbono carbonílico desde dos lados. La urea se produce naturalmente en mamíferos en el metabolismo del nitrógeno. Esto se conoce como el ciclo de urea, y la oxidación de amoníaco o aminoácidos produce urea dentro de nuestros cuerpos. La mayor parte de la urea se excreta a través de los riñones con orina, mientras que algunos se excretan con sudor. La alta solubilidad de agua de la urea es útil cuando la excreta del cuerpo. La urea es un sólido incoloro e inodoro, y no es tóxico. Además de ser un producto metabólico, su uso principal es producir fertilizantes. La urea es uno de los fertilizantes que liberan nitrógeno más comunes, y tiene un alto contenido de nitrógeno en comparación con otros fertilizantes nitrógenos sólidos. En el suelo, la urea se convierte en amoníaco y dióxido de carbono. Este amoníaco se puede convertir a nitrito por bacterias del suelo. Además, la urea se usa para producir explosivos como el nitrato de urea. Se usa también como materia prima para producir productos químicos como plásticos y adhesivos.
| Cuál es la diferencia entre Nitrato de amonio y urea? • La fórmula molecular de nitrato de amonio es NH4NO3. La fórmula molecular de la urea es CO (NH2)2. • El nitrato de amonio es una sal, mientras que la urea no es. Es una carbamida (molécula orgánica). • Cuando se disuelve en agua, el nitrato de amonio produce una solución ácida. En contraste, las soluciones de urea no son ácidas ni alcalinas. |


