Diferencia entre anfiprótico y anfotérico
Anfiprótico vs anfotérico
Como anfiprótico y anfotérico son bastante similares, la diferencia entre anfiprótica y anfotérica también es bastante confusa. Ambos términos, anfipróticos y anfotéricos, están relacionados con la química ácida-base. Las sustancias anfotéricas se comportan como un ácido y como base. Todas las sustancias anfipróticas pueden donar y aceptar protones y pueden mostrar propiedades ácidas y base. Por lo tanto, también son anfotéricos. Este artículo describe la diferencia entre las sustancias anfipróticas y las sustancias anfotéricas en detalle. Además, da ejemplos y reacciones para mostrar sus propiedades.
¿Qué son las sustancias anfipróticas??
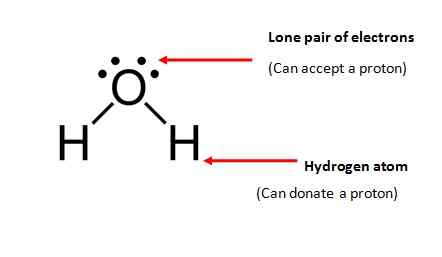
El término anfiprótico se refiere a las sustancias que pueden aceptar y donar un protón; puede ser iónico o covalente. Por lo tanto, una sustancia anfotérica debe tener dos propiedades principales.
- La molécula debe contener al menos un átomo de hidrógeno y puede donarse a otra molécula.
- La molécula debe contener un par solitario de electrones (electrones que no están involucrados en la unión química) para aceptar un protón.
Agua (H2O) es de las sustancias anfipróticas más comunes; Una molécula de agua satisface ambos requisitos necesarios para una sustancia anfiprótica.

Además del agua, la mayoría de las bases conjugadas de los ácidos dipróticos pueden actuar como sustancias anfipróticas.
Base conjugada de ácido diprótico
H2ENTONCES4 HSO4-
H2CO3 HCO3-
H2S HS-
H2Cro3 Hcro3-
Ejemplo: ácido carbónico (H2CO3) es un ácido diprótico débil, bicarbonato (HCO3-) es su base conjugada. En soluciones acuosas, el bicarbonato muestra dos tipos de reacciones.
(1) Donar un protón al agua (como un bronsted - ácido Lowry)
HCO3- (aq) + H2O -> h3O+ (aq) + CO32- (aq)
(2) Aceptar un protón del agua (como una base bronsted - Lowry)
HCO3- (aq) + H2O -> h2CO3 (aq) + OH- (aq)
Por lo tanto, bicarbonato (HCO3-) es una especie anfiprótica.
¿Qué son las sustancias anfotéricas??
Las sustancias que pueden actuar como ácido y base se denominan sustancias anfotéricas. Esta definición es bastante similar a las sustancias anfipróticas. Porque, todas las sustancias anfipróticas muestran propiedades ácidas al donar un protón y, de manera similar, muestran propiedades básicas al aceptar un protón. Por lo tanto, todas las sustancias anfipróticas pueden considerarse anfotéricas. Sin embargo, la declaración inversa no siempre es cierta.
Tenemos tres teorías para ácidos y bases:
Teoría base ácida
Arrhenius H+ productor oh- productor
Bronsted-lowry h+ donante h+ accesco
Lewis Electron Par Donor de pares de electrones aceptores
Ejemplo: Al2O3 es un ácido de Lewis y una base de Lewis. Por lo tanto, es una sustancia anfotérica, ya que no contiene protones (H+), no es una sustancia anfiprótica.
Alabama2O3 Como base:
Alabama2O3 + 6 HCL-> 2 ALCL3 + 3 h2O
Alabama2O3 como un ácido:
Alabama2O3 + 2NaOH + 3 H2O -> naal (oh)4
¿Cuál es la diferencia entre anfiprótico y anfotérico??
• Una sustancia anfiprótica se comporta como un ácido y como base. Una sustancia anfotérica puede aceptar o donar un protón (h+ ion).
• Todas las sustancias anfotéricas son anfipróticas, pero todas las sustancias anfipróticas no son anfotéricas.
• Las especies anfipróticas consideran la capacidad de donar o aceptar un protón. Sin embargo, las especies anfotéricas consideran la capacidad de actuar como un ácido y como una base. Las propiedades ácido-base dependen de tres factores, incluida la capacidad de donar o aceptar un protón.
Si una sustancia posee un par de electrones para donar y tiene la capacidad de aceptar un par de electrones se considera anfotérica.
Si una sustancia tiene la capacidad de producir tanto ion como ion como oh-ion, se considera anfotérica.
Resumen:
Anfiprótico vs anfotérico
Las sustancias anfotéricas y anfipróticas están relacionadas con la química ácida-base. Ambas sustancias muestran propiedades ácidas y base. En otras palabras, pueden reaccionar como un ácido y como base dependiendo de los otros reactivos. Las sustancias anfipróticas pueden donar y aceptar un protón. El agua es el ejemplo más común para una especie anfiprótica. La mayoría de las bases conjugadas de ácidos dipróticos también anfipróticos. Las sustancias anfotéricas pueden comportarse como un ácido y como base.


