Diferencia entre anilina y acetanilida
Diferencia clave: anilina vs acetanilida
La anilina y la acetanilida son dos derivados de benceno con dos grupos funcionales diferentes. La anilina es una amina aromática (con -nh2 grupo), y la acetanilida es una amida aromática (con -conh- grupo). La diferencia en su grupo funcional conduce a otras variaciones sutiles en las propiedades físicas y químicas entre estos dos compuestos. Ambos se usan en muchas aplicaciones industriales, pero en varios campos para diferentes fines. El diferencia clave es eso, En términos de basicidad, la acetanilida es mucho más débil que la anilina.
Qué es Anilina?
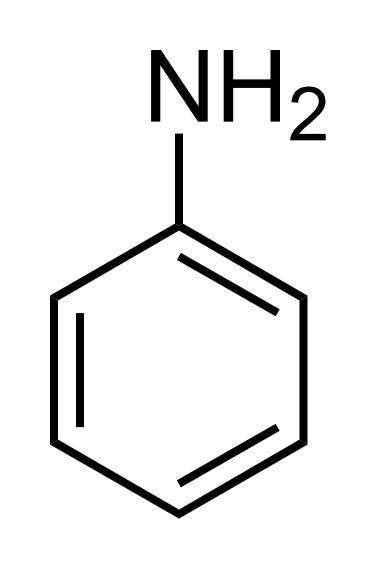
Anilina es un derivado de benceno con la fórmula química de C6H5NUEVA HAMPSHIRE2. Es una amina aromática también conocida como aminobenceno o fenilamina. La anilina es un incoloro a marrón líquido con una característica olor penetrante. Es un inflamable, ligeramente soluble en agua y es aceitoso. Su punto de fusión y punto de ebullición son -6 0C y 1840C respectivamente. Su densidad es mayor que la del agua, y el vapor es más pesado que el aire. La anilina se considera un químico tóxico y causa efectos nocivos a través de la absorción e inhalación de la piel. Produce óxidos de nitrógeno tóxicos durante la combustión.

Qué es Acetanilida?
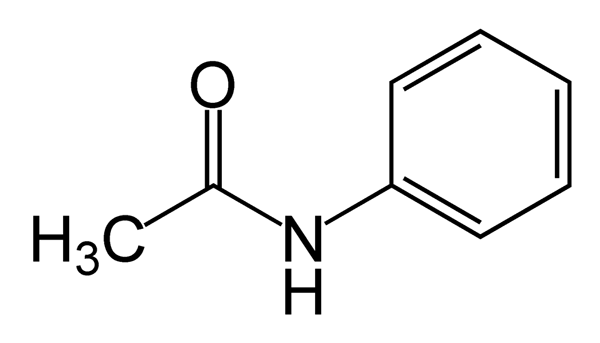
La acetanilida es una amida aromática con la fórmula molecular C6H5NH (Coch3). Es un inodoro, Flake de blanco a gris sólido o polvo cristalino a temperatura ambiente. La acetanilida es soluble en pocos solventes que incluyen agua caliente, alcohol, éter, cloroformo, acetona, glicerol y benceno. Su punto de fusión y punto de ebullición son 114 0C y 304 0C respectivamente. Puede sufrir autogelición en 545 0C, pero estable en la mayoría de las otras condiciones.
La acetanilida se usa en varias industrias para diferentes fines; Por ejemplo, se usa principalmente como intermedios en la síntesis de productos farmacéuticos y tintes, como aditivo en peróxido de hidrógeno, barnices y éster de celulosa. Además, se utiliza como plastificante en la industria de polímeros y como acelerador en la industria del caucho.
¿Cuál es la diferencia entre anilina y acetanilida??
Estructura:
Anilina: La anilina es una amina aromática; a -nh2 El grupo está unido al anillo de benceno.
Acetanilida: La acetanilida es una amida aromática con una3 Grupo unido al anillo de benceno.
Usos:
Anilina: Aniline tiene varias aplicaciones industriales. Se utiliza para preparar otras sustancias químicas como productos químicos fotográficos y agrícolas, polímeros y la industria de tinte y caucho. Además, también se usa como solvente y un compuesto antiknock para gasolina. También se usa como precursor en la fabricación de penicilina.
Acetanilida: La acetanilida se usa principalmente como inhibidor de los peróxidos y como estabilizador para los barnices de éster de celulosa. Además, se utiliza como intermedio para la síntesis de aceleradores de goma, colorantes y tinte intermedio y alcanfor. Además, se utiliza como precursor en la síntesis de penicilina y otros productos farmacéuticos, incluidos analgésicos.
Basicidad:
Anilina: La anilina es una base débil que reacciona con ácidos fuertes que producen iones de anilinio (C6H5-NUEVA HAMPSHIRE3+). Tiene una base mucho más débil en comparación con las aminas alifáticas debido al efecto de extracción de electrones en el anillo de benceno. A pesar de ser una base débil, la anilina puede precipitar el zinc, el aluminio y las sales férricas. Además, expulsa el amoníaco de las sales de amonio al calentar.
Acetanilida: La acetanilida es una amida, y las amidas son bases muy débiles; son incluso menos básicos que el agua. Esto se debe al grupo carbonilo (C = O) en amidas; C = O es un dipolo fuerte que el dipolo N-C. Por lo tanto, la capacidad del grupo N-C para actuar como aceptador de enlaces H (como base) está restringida en presencia de un dipolo C = O.
Imagen de cortesía:
1. Anilina por Calvero. (Hecho a sí mismo con Chemdraw.) [Dominio público], a través de Wikimedia Commons
2. Acetanilida por runa.Galés en English Wikipedia [Dominio público, GFDL, CC-By-SA-3.0 o CC por 2.5], a través de Wikimedia Commons


