Diferencia entre antibonding y no vínculo
El diferencia clave entre antibonding y no vínculo es que Los orbitales de antibonding aumentan la energía de una molécula, mientras que los orbitales no de combate no cambian la energía de una molécula.
Los términos antibonding y no vinculación están bajo la teoría orbital molecular. Según esta teoría, estos orbitales son orbitales híbridos que se forman debido a la superposición de otros orbitales.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es antibonding
3. ¿Qué no esborable?
4. Comparación de lado a lado: antibonding frente a no unión en forma tabular
5. Resumen
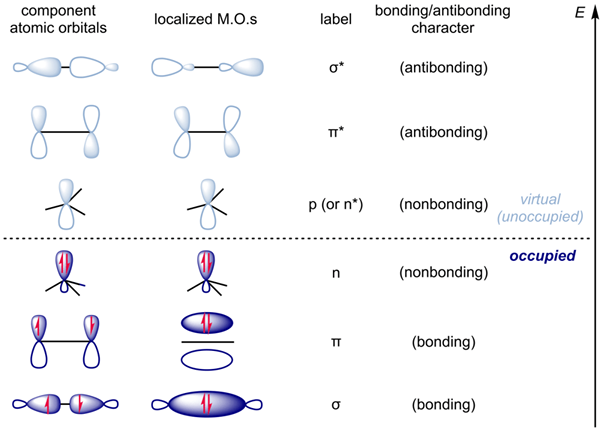
Que es antibonding?
Los orbitales moleculares de antibonding son orbitales que contienen electrones fuera de la región entre dos núcleos atómicos. Los electrones en los orbitales de antibonding reducen la estabilidad de una molécula, ya que estos electrones pasan la mayor parte de su tiempo fuera de los núcleos atómicos. Por lo tanto, la densidad electrónica de los orbitales moleculares de antibonding es menos en comparación con los orbitales moleculares de enlace, y los orbitales moleculares de antibonding indican la densidad de electrones fuera del enlace.
Los orbitales moleculares de antibonding tienen mayor energía que la de los orbitales atómicos y los orbitales moleculares de enlace. Esto se debe a que los electrones en estos orbitales no contribuyen a la reducción de la repulsión entre dos núcleos atómicos. Por lo tanto, la estabilidad de los compuestos que tienen electrones en los orbitales moleculares de antibonding es menor. Sin embargo, en los compuestos estables, la presencia de electrones en los orbitales moleculares de antibonding es ni menos o menos. Además, la disposición espacial de los orbitales moleculares de antibonding no determina la forma o la geometría de una molécula.

Según la imagen anterior, la densidad de electrones en la unión del orbital molecular es igual a la del orbital molecular de antibonding. Por lo tanto, es una molécula muy inestable. Por lo tanto, la molécula HE2 no existe. El orbital molecular de antibonding se da como σ*.
¿Qué no esborable??
El orbital no vinculante es el orbital molecular en el que la adición o eliminación de electrones no aumenta ni disminuye el orden de enlace entre los átomos. A menudo designamos este orbital por "n". Estos orbitales se parecen a los pares de electrones solitarios en las estructuras de Lewis.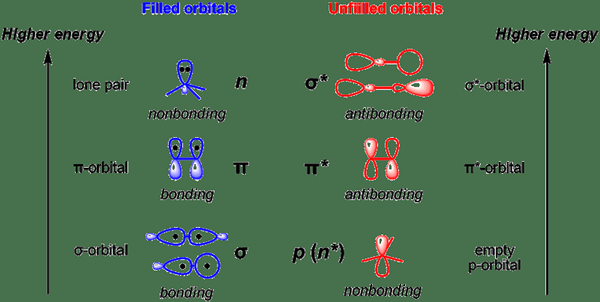
Además, la energía de un orbital que no tiene un sintonismo es entre la energía orbital de antibonding y la unión orbital.
¿Cuál es la diferencia entre antibonding y no acoplamiento??
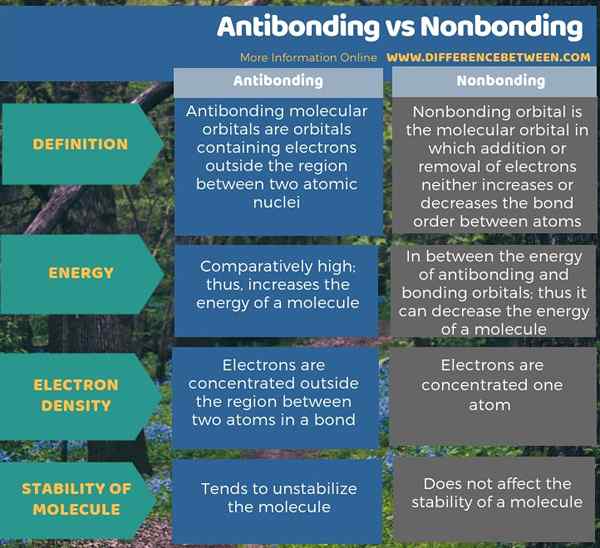
Los orbitales de antibonding y no fastidios son orbitales moleculares. La diferencia clave entre la antibondación y la falta de enlace es que los orbitales de antibonding aumentan la energía de una molécula, mientras que los orbitales no de bonding no cambian la energía de una molécula de una molécula. Además, la presencia de orbitales de antibonding tiende a ilustrar la molécula, mientras que los orbitales no de bucle no tienen ningún efecto sobre la estabilidad de la molécula.
Resumen -Antibonding vs no vinculante
Los orbitales de antibonding y no fastidios son orbitales moleculares. La diferencia clave entre la antibondación y la falta de enlace es que los orbitales de antibonding aumentan la energía de una molécula, mientras que los orbitales no de bonding no cambian la energía de una molécula de una molécula.
Referencia:
1. Helmenstine, Anne Marie. “Definición orbital de antibonding."Thinkco, Jul. 3, 2019, disponible aquí.
Imagen de cortesía:
1. "Mos localizado" de Alsosaid1987 - Trabajo propio (CC BY -SA 4.0) a través de Commons Wikimedia
2. "Orbitales moleculares localizados de dibujos animados" por Alsosaid1987 - Trabajo propio (CC BY -SA 4.0) a través de Commons Wikimedia


