Diferencia entre la economía del átomo y el rendimiento porcentual
Diferencia clave: la economía del átomo frente al rendimiento porcentual
La economía del átomo y el rendimiento porcentual se utilizan para determinar la eficiencia de la síntesis química. La determinación de la economía del átomo es muy importante porque da detalles sobre cuán más verde es el proceso. También indica el desperdicio de átomos durante el proceso. El rendimiento porcentual es la cantidad de producto dada por una reacción química con respecto a la cantidad calculada esperada (la cantidad teórica). La diferencia clave entre la economía del átomo y el rendimiento porcentual es que La economía del átomo se calcula dividiendo la masa molar del producto deseado mediante la masa molar de todos los reactivos, mientras que el rendimiento porcentual se calcula sumergiendo el rendimiento real del producto del rendimiento teórico del producto.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la economía del átomo?
3. ¿Cuál es el rendimiento porcentual?
4. Similitudes entre la economía del átomo y el rendimiento porcentual
5. Comparación de lado a lado - Economía de átomo versus rendimiento porcentual en forma tabular
6. Resumen
¿Qué es la economía del átomo??
Economía atómica o eficiencia de átomos es la determinación de la eficiencia de una síntesis química con respecto a los átomos utilizados durante la reacción de síntesis. Si la economía del átomo es del 100%, significa que todos los átomos que estuvieron involucrados en el proceso se han utilizado durante el proceso. Esto significa que todos los átomos en los reactivos se han convertido en átomos del producto. Si la economía atómica de un proceso es alta, se llama proceso verde.
Ecuación para el cálculo de la economía del átomo
La determinación de la economía del átomo se puede hacer a través de la siguiente ecuación.
Economía de átomo = (masa molar del producto deseado/masa molar de todos los reactivos) x 100%

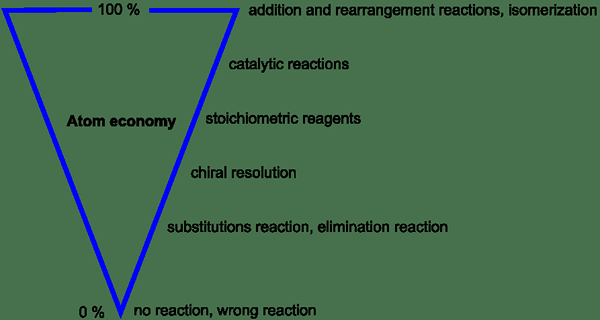
Figura 1: Variación de la economía del átomo basada en diferentes parámetros
En un proceso ideal, todos los átomos en los reactivos son utilizados por el proceso y se convierten en reactivos. Por lo tanto, no se desperdicia ningún átomo. Pero en los procesos reales, la economía del átomo es inferior al 100%. Esto se debe a la producción de subproductos en lugar de dar solo el producto deseado. Esta es una preocupación importante cuando se trata del proceso que consume materias primas de alto costo.
Ejemplo
Producción de anhídrido maleico a partir de benceno. Esta es una reacción de oxidación; Los reactivos involucrados en el proceso son benceno y oxígeno molecular.
Benceno + 4.5oxígeno → anhídrido maleico + 2carbon dióxido + 2 agua
Masa molar del producto deseado = (12 × 4) + (16 × 3) + (1 × 2)
= 98 g/mol
Masa molar de todos los reactivos; benceno = (12 × 6) + (1 × 6)
= 78 g/mol
Oxígeno molecular = 4.5 (16 × 2)
= 144 g/mol
La masa total de reactivos = 78 + 144
= 222 g/mol
Atom Economy = (98/222) x 100%
= 44.14%
¿Cuál es el rendimiento porcentual??
Rendimiento porcentual (también llamado porcentaje de rendimiento) es el rendimiento real obtenido de una reacción de síntesis química, con respecto al rendimiento teórico. El valor se da como porcentaje. El rendimiento real es lo que obtenemos del experimento, mientras que el rendimiento teórico es el valor calculado a partir de la ecuación de la reacción química, considerando la estequiometría.
Al calcular el rendimiento teórico, uno debe considerar el reactivo limitante. Limitar el reactivo o el reactivo limitante es el reactivo que determina cuánto del producto se ha realizado. El reactante limitante se consume durante la reacción donde otros reactivos permanecen incluso después de la finalización de la reacción porque son reactivos en exceso.
Cómo encontrar el reactivo limitante?
Ej: Consideremos la reacción entre Al (14 g) y CL2 (4.25 g) gas. El producto final es ALCL3.
2al+ 3cl2 → 2Alcl3
Tesos de Al presente = 14/26.98 = 0.52 moles
Los lunares de CL2 presente = 4.25/70.90 = 0.06 mol
Relación estequiométrica entre Al y CL2 = 2: 3
Por lo tanto, 2 moles de Al reaccionan con 3 moles de CL2. Entonces la cantidad de cl2 requerido para reaccionar con 0.52 mol de AL es = (3/2) x 0.52 = 0.78 moles
Pero solo 0.06 mol está presente. Por lo tanto, cl2 es el reactivo limitante aquí. Entonces el rendimiento teórico se calcula utilizando la cantidad de AL presente en la mezcla de reacción.
Rendimiento teórico = (2/3) x 0.06 x 133.3 = 5.33 g
Si el rendimiento real obtenido del experimento se da como 4.33G, entonces el rendimiento porcentual se puede calcular de la siguiente manera.
Rendimiento porcentual = (4.33/5.33) x 100% = 81.24%
¿Cuáles son las similitudes entre la economía del átomo y el rendimiento porcentual??
- Tanto la economía del átomo como el rendimiento porcentual son porcentajes.
- Tanto la economía del átomo como el rendimiento porcentual son muy útiles para determinar la eficiencia de un proceso químico.
¿Cuál es la diferencia entre la economía del átomo y el rendimiento porcentual??
Economía del átomo versus rendimiento porcentual | |
| La economía del átomo es la determinación de la eficiencia de una síntesis química con respecto a los átomos utilizados durante la reacción de síntesis. | El rendimiento porcentual es el rendimiento real obtenido de una reacción de síntesis química, con respecto al rendimiento teórico. |
| Objetivo | |
| La economía del átomo se calcula para estimar la eficiencia de un proceso y determinar el desperdicio de átomos. | El rendimiento porcentual se calcula para determinar la cantidad de producto dado prácticamente en comparación con las expectativas teóricas. |
| Cálculo | |
| La economía del átomo se calcula dividiendo la masa molar del producto deseado por la masa molar de todos los reactivos | El rendimiento porcentual se calcula sumergiendo el rendimiento real del producto del rendimiento teórico del producto. |
Resumen -Economía Atom vs rendimiento porcentual
La economía del átomo y el rendimiento porcentual son valores porcentuales que se calculan con respecto a las reacciones químicas. La diferencia clave entre la economía del átomo y el rendimiento porcentual es que la economía del átomo se calcula dividiendo la masa molar del producto deseado por la masa molar de todos los reactivos, mientras que el rendimiento porcentual se calcula al sumergir el rendimiento real del producto del rendimiento teórico de el producto.
Referencia:
1. "Reactivos limitantes y rendimiento porcentual."Khan Academy, disponible aquí.
2. "Economía atómica."Wikipedia, Fundación Wikimedia, 28 de febrero. 2018, disponible aquí.
Imagen de cortesía:
1."Atom Economy v3 en" por Astrid 91 - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia


