Diferencia entre la masa atómica y la masa atómica promedio
El diferencia clave entre la masa atómica y la masa atómica promedio es que la La masa atómica es la masa de un átomo, mientras que la masa atómica promedio es la masa de un átomo de un elemento químico particular calculado al considerar los isótopos de ese elemento.
A menudo usamos los términos masa atómica y masa atómica promedio indistintamente; Sin embargo, son dos términos diferentes.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la masa atómica?
3. ¿Qué es la masa atómica promedio?
4. Comparación lado a lado: masa atómica vs masa atómica promedio en forma tabular
5. Resumen
¿Qué es la masa atómica??
La masa atómica es la masa total de nucleones presentes en el núcleo de un átomo. Un nucleón es un P7P o un neutrón. Por lo tanto, la masa atómica es la masa total de los protones y neutrones presentes en el núcleo. Aunque los electrones también están presentes en los átomos, la masa de electrones no se usa en los cálculos porque los electrones son muy pequeños y tienen una masa insignificante en comparación con los protones y neutrones.
A diferencia de la masa atómica relativa, aquí calculamos la masa de cada átomo sin calcular ningún valor promedio. Por lo tanto, obtenemos diferentes valores para masas atómicas de diferentes isótopos. Esto se debe a que el número de nucleones presentes en isótopos del mismo elemento es diferente entre sí.

Consideremos un ejemplo:
La masa atómica de hidrógeno = 2
Entonces, la masa atómica del isótopo de hidrógeno-2 (Deuterium) se calcula de la siguiente manera.
El número de protones en el núcleo = 1
El número de neutrones en el núcleo = 1
Por lo tanto, la masa atómica de hidrógeno = (1 amu + 1 amu) = 2 amu
Aquí, la masa atómica viene dada por la unidad AMU (unidades de masa atómica). Un protón o un neutrón tiene una masa de 1 amu.
¿Qué es la masa atómica promedio??
La masa atómica promedio es la masa de un átomo de un elemento químico particular calculado al considerar los isótopos de ese elemento. En esto, el valor de masa depende de la abundancia natural de un elemento químico.
Hay dos pasos para calcular la masa atómica promedio.
- Multiplique la masa atómica de cada isótopo a partir de la abundancia natural (tomando la abundancia como porcentaje) por separado.
- Agregue los valores obtenidos juntos para obtener la masa atómica promedio.
Consideremos un ejemplo:
Hay dos isótopos de carbono como carbono-12 y carbono-13. Su abundancia es del 98% y 2, respectivamente. Entonces podemos determinar la masa atómica promedio de carbono utilizando un cálculo. Aquí, tenemos que multiplicar las masas atómicas de cada isótopo con el valor de abundancia. Luego, debemos tomar la abundancia como un valor colocado en dos decimales, no como el porcentaje. A continuación, podemos agregar los valores obtenidos.
Carbono-12: 0.98*12 = 11.76
Carbono-13: 0.02*13 = 0.26
Entonces, la masa atómica promedio de carbono es = 11.76+0.26 = 12.02 g/mol.
¿Cuál es la diferencia entre la masa atómica y la masa atómica promedio??
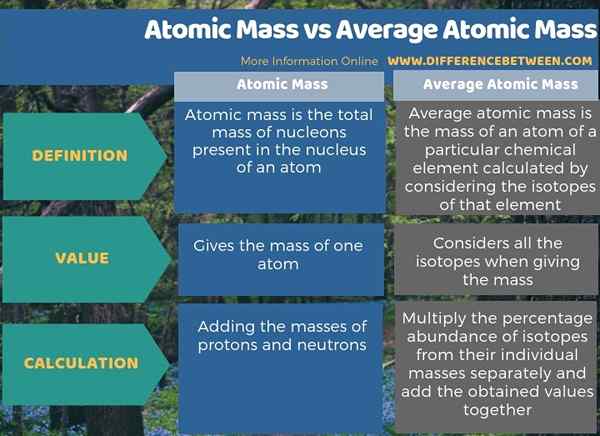
Aunque el término masa atómica y la masa atómica promedio suenan similares, son dos términos diferentes. La diferencia clave entre la masa atómica y la masa atómica promedio es que la masa atómica es la masa de un átomo, mientras que la masa atómica promedio es la masa de un átomo de un elemento químico particular calculado al considerar los isótopos de ese elemento. El término masa atómica se refiere a la masa de un solo átomo, mientras que el término masa atómica promedio se refiere a una masa de un elemento químico.
Resumen -Masa atómica vs masa atómica promedio
La masa atómica se refiere a la masa de un solo átomo, pero la masa atómica promedio se refiere a la masa promedio de un átomo de un elemento químico particular. Por lo tanto, la diferencia clave entre la masa atómica y la masa atómica promedio es que la masa atómica es la masa de un átomo, mientras que la masa atómica promedio es la masa de un átomo de un elemento químico particular calculado al considerar los isótopos de ese elemento.
Referencia:
Helmenstine, Anne Marie. "Cómo calcular la masa atómica."Thinkco, agosto. 21, 2019, disponible aquí.
Helmenstine, Anne Marie. "Cómo calcular la masa atómica."Thinkco, agosto. 21, 2019, disponible aquí.
Imagen de cortesía:
1. "Atomo estilizado con tres órbitas modelo Bohr y núcleo estilizado" por SVG por indolencias. Recollar y planchar algunos problemas técnicos hechos por Rainer Klute. - Trabajo propio basado en: de imagen: átomo de litio estilizado.PNG de Halfdan (CC BY-SA 3.0) a través de Commons Wikimedia


