Diferencia entre la masa atómica y el peso molecular
El diferencia clave entre la masa atómica y el peso molecular es que el La masa atómica es la masa de un solo átomo, mientras que el peso molecular es la suma de los pesos de los átomos en la molécula.
Los átomos son los bloques de construcción de toda. Un átomo tiene peso; es masa atómica. Los átomos pueden unirse en varias combinaciones, para formar moléculas y otros compuestos. Las estructuras moleculares dan las proporciones exactas de los átomos; Por lo tanto, podemos escribir fórmulas moleculares para compuestos. Estos son importantes para determinar el peso molecular.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la masa atómica?
3. ¿Qué es el peso molecular?
4. Comparación de lado a lado - Masa atómica vs peso molecular en forma tabular
5. Resumen
¿Qué es la masa atómica??
Los átomos contienen principalmente protones, neutrones y electrones. La masa atómica es simplemente la masa de un átomo. En otras palabras, es la colección de masas de todos los neutrones, protones y electrones en un solo átomo, específicamente, cuando el átomo no se mueve (masa de descanso). Tomamos la masa en su descanso porque, según los fundamentos de la física, cuando los átomos se mueven a una velocidad muy alta, las masas aumentan.
Sin embargo, la masa de un electrón es considerablemente muy pequeña en comparación con las masas de protones y neutrones. Por lo tanto, podemos decir que la contribución de los electrones a una masa atómica es menor. La mayoría de los átomos en la tabla periódica tienen dos o más isótopos. Los isótopos difieren entre sí al tener un número diferente de neutrones, a pesar de que tienen la misma cantidad de protones y electrones. Dado que su cantidad de neutrones es diferente, cada isótopo tiene una masa atómica diferente.

Figura 01: Masas atómicas de elementos químicos
Además, las masas de átomos son extremadamente pequeñas; Por lo tanto, no podemos expresarlos en unidades de masa normales como gramos o kilogramos. Para nuestros propósitos, estamos utilizando otra unidad de masa atómica de la unidad (AMU) para medir la masa atómica. 1 Unidad de masa atómica es la décima parte de la masa de un isótopo C-12. Cuando dividimos la masa de un átomo por la masa de una duodécima parte de la masa de un isótopo C-12, podemos obtener su masa relativa. Sin embargo, en el uso general cuando decimos la masa atómica relativa de un elemento, nos referimos a su peso atómico (porque lo calculamos considerando todos los isótopos).
¿Qué es el peso molecular??
El peso molecular es la recolección de pesos de todos los átomos en una molécula. La unidad SI de este parámetro es GMOL-1. Esto da la cantidad de átomos/moléculas/compuestos presentes en un lunar de la sustancia. En otras palabras, es la masa del número de avogadro de átomos/moléculas o compuestos.
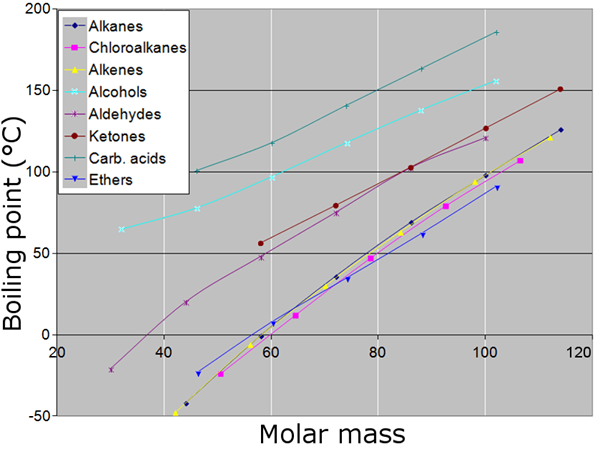
Figura 02: Puntos de ebullición y masas molares (pesos moleculares) de diferentes compuestos
Es importante medir el peso de los átomos y las moléculas en el escenario práctico. Pero es difícil sopesarlas como partículas individuales, ya que sus masas son extremadamente pequeñas de acuerdo con los parámetros de pesaje normales (gramos o kilogramos). Por lo tanto, para cumplir esta brecha y medir las partículas en un nivel macroscópico, el concepto de masa molar es muy útil.
La definición de peso molecular se relaciona directamente con el isótopo de carbono-12. La masa de un lunar de carbono 12 átomos es exactamente 12 gramos, que es su masa molar es exactamente 12 gramos por lunar. Además, podemos calcular el peso molecular de las moléculas que contienen los mismos átomos como O2 o n2 multiplicando el número de átomos por el peso atómico de los átomos. Sin embargo, el peso molecular de los compuestos como NaCl o CUSO4 se calcula agregando los pesos atómicos de cada átomo.
¿Cuál es la diferencia entre la masa atómica y el peso molecular??
La masa atómica da la masa de átomos, mientras que el peso molecular da la masa de moléculas. Sin embargo, la diferencia clave entre la masa atómica y el peso molecular es que la masa atómica es la masa de un solo átomo, mientras que el peso molecular es la suma de los pesos de los átomos en la molécula. Como otra diferencia significativa entre la masa atómica y el peso molecular, la unidad de medición de la masa atómica es amu, mientras que la unidad para el peso molecular es g/mol.
Además, hay una diferencia entre la masa atómica y el peso molecular en la forma en que calculamos estas dos cantidades. Podemos determinar la masa atómica fácilmente mediante la adición de las masas de neutrones, protones y electrones del átomo. Sin embargo, determinamos la masa de una molécula o el peso molecular de una molécula al agregar las masas promedio de átomos en la molécula.
La siguiente ilustración presenta la diferencia entre la masa atómica y el peso molecular en forma tabular.
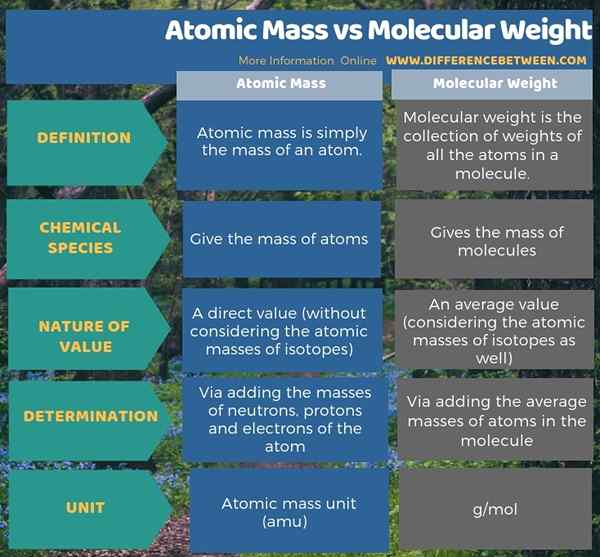
Resumen -Masa atómica vs peso molecular
Utilizamos los términos masa atómica y peso molecular principalmente en los cálculos de química general para determinar los valores con respecto a las reacciones químicas; como la cantidad de reactivos, productos, etc. La diferencia clave entre la masa atómica y el peso molecular es que la masa atómica es la masa de un solo átomo, mientras que el peso molecular es la suma de los pesos de los átomos en la molécula.
Referencia:
1.Helmenstine, Anne Marie, PH.D. "Cómo calcular la masa atómica."Thinkco, dec. 5, 2018. Disponible aquí
Imagen de cortesía:
1."Tabla periódica de elementos de masa atómica en blanco y negro" por DMarcus100 - Trabajo propio, (CC BY -SA 4.0) a través de Commons Wikimedia
2."Punto de ebullición vs gráfico de masa molar" por JPTA - Trabajo propio, (CC By -SA 3.0) a través de Commons Wikimedia


