Diferencia entre la unidad de masa atómica y la masa atómica
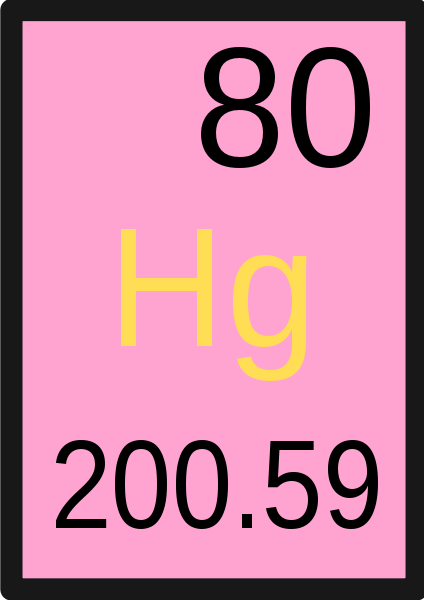
El diferencia clave entre la unidad de masa atómica y la masa atómica es que el La unidad de masa atómica es la unidad que usamos para medir la masa de un átomo, mientras que la masa atómica es la masa de un átomo único particular.
Expresar los pesos de átomos o moléculas fue un problema para los científicos en las primeras etapas. Dado que los átomos son extremadamente pequeños, no podemos medir sus masas usando unidades regulares como kilogramos o gramos o incluso en microgramos. Por lo tanto, a los científicos se les ocurrió un nuevo concepto para medir estos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la unidad de masa atómica?
3. ¿Qué es la masa atómica?
4. Comparación de lado a lado - Unidad de masa atómica vs masa atómica en forma tabular
5. Resumen
¿Qué es la unidad de masa atómica??
Las masas de átomos son extremadamente pequeñas. Por lo tanto, no podemos expresarlos en unidades de masa normales como gramos o kilogramos. Por lo tanto, necesitamos usar otra unidad llamada Unidad de masa atómica (AMU) para medir la masa atómica. Una unidad de masa atómica es una vigésima parte de la masa de un isótopo C-12, que es 1.66 x 10−27 kg. Cuando dividimos la masa de un átomo en una moneda XVIS de la masa de un isótopo C-12, podemos obtener su masa relativa. Y, este valor es un número pequeño, que es fácil de usar en los cálculos y para otros fines. Sin embargo, en uso general, cuando decimos la masa atómica relativa de un elemento, nos referimos a su peso atómico (porque lo calculamos considerando todos los isótopos).
Antes de usar carbono-12 como estándar para medir la unidad de masa atómica, las personas usaron otros elementos. Por ejemplo, H-1 se usó primero. Más tarde, cambiaron esto para reducir los errores. Después de eso, usaron elementos con masas más altas. El siguiente estándar fue Oxygen-16. Más tarde, con el descubrimiento de la presencia de isótopos de oxígeno y otros problemas relacionados con ella, la unidad de masa atómica se midió en relación con el isótopo de carbono-12.
¿Qué es la masa atómica??
Los átomos contienen principalmente protones, neutrones y electrones. La masa atómica es simplemente la masa de un átomo. En otras palabras, es la colección de masas de todos los neutrones, protones y electrones en un solo átomo, específicamente, cuando el átomo no se mueve (masa de descanso). Deberíamos tomar la masa del resto porque, según los fundamentos de la física, cuando los átomos se mueven a una velocidad muy alta, las masas aumentan.
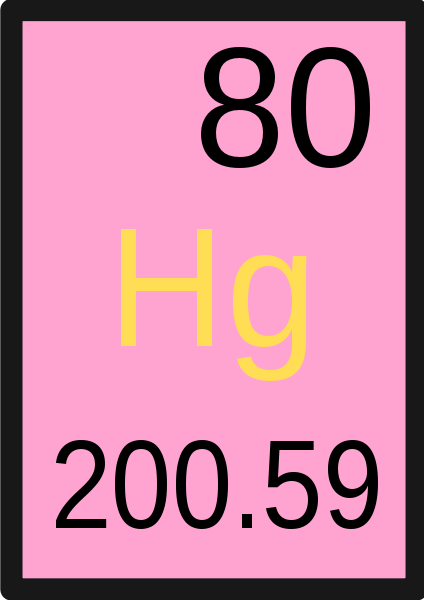
Figura 01: la masa atómica de mercurio es 200.59 amu
Sin embargo, la masa de electrones es considerablemente pequeña en comparación con las masas de protones y neutrones. Por lo tanto, podemos decir que la contribución de un electrón a la masa atómica es menor. La mayoría de los átomos en la tabla periódica tienen dos o más isótopos. Los isótopos difieren entre sí al tener un número diferente de neutrones, a pesar de que tienen la misma cantidad de protones y electrones. Dado que su cantidad de neutrones es diferente, cada isótopo tiene una masa atómica diferente. El promedio de toda la masa de isótopos es el peso atómico. Por lo tanto, la masa de un isótopo específico es la masa atómica en un átomo, que tiene varios isótopos.
¿Cuál es la diferencia entre la unidad de masa atómica y la masa atómica??
La masa atómica es la masa de un átomo específico (sin tomar la masa promedio de isótopos). La unidad de masa atómica es la 1/12 de la masa de isótopo de carbono -12. Por lo tanto, la diferencia clave entre la unidad de masa atómica y la masa atómica es que la unidad de masa atómica es la unidad que usamos para medir la masa de un átomo, mientras que la masa atómica es la masa de un átomo único particular. Además, podemos usar una unidad de masa atómica para indicar las masas relativas de otros átomos en relación con la masa C-12.
La siguiente infografía sobre la diferencia entre la unidad de masa atómica y la masa atómica resume todas estas diferencias.
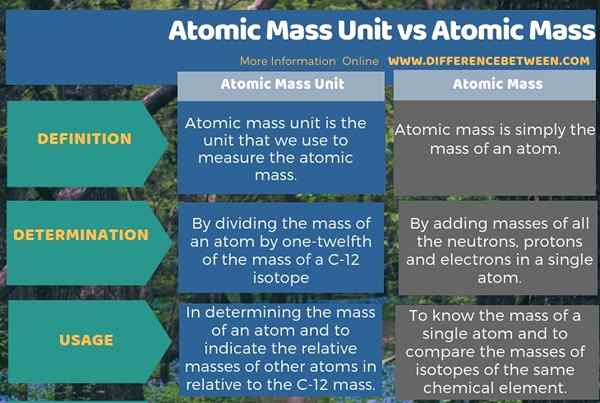
Resumen -Unidad de masa atómica vs masa atómica
La unidad de masa atómica es la unidad de medición de la masa atómica de un solo átomo. La diferencia clave entre la unidad de masa atómica y la masa atómica es que la unidad de masa atómica es la unidad que usamos para medir la masa de un átomo, mientras que la masa atómica es la masa de un átomo único particular.
Referencia:
1. Helmenstine, Anne Marie, PH.D. "Masa atómica y número de masa atómica (revisión rápida)."Thinkco, junio. 13, 2018. Disponible aquí
Imagen de cortesía:
1."Mercurio (elemento)" por mí (CC By-SA 2.5) Vía Commons Wikimedia