Diferencia entre el peso atómico y la masa atómica
El diferencia clave entre el peso atómico y la masa atómica es que El peso atómico es el peso promedio de un elemento, con respecto a todos sus isótopos y sus abundancias relativas, pero la masa atómica es la masa de un solo átomo.
La mayoría de las personas usan los términos masa atómica y peso atómico indistintamente. Sin embargo, tienen diferentes significados, y causa un error significativo en los cálculos de materiales a granel si tomamos estos dos términos como uno.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el peso atómico?
3. ¿Qué es la masa atómica?
4. Comparación de lado a lado: peso atómico vs masa atómica en forma tabular
5. Resumen
¿Qué es el peso atómico??
El peso atómico es el peso promedio de un elemento, con respecto a todos sus isótopos y sus abundancias relativas. La mayoría de las veces, los elementos químicos tienen isótopos; Los isótopos son las diferentes formas del mismo elemento químico. Los isótopos tienen el mismo número de protones (lo que los hace pertenecer al mismo elemento químico) y diferentes números de neutrones en el núcleo atómico. Hay diferentes porcentajes de diferentes isótopos que ocurren en la naturaleza. Necesitamos considerar las masas atómicas de todos los isótopos y sus porcentajes al obtener el peso atómico de un elemento químico. Allí, podemos calcular la masa promedio utilizando las masas atómicas de cada isótopo para obtener el peso atómico. El peso atómico que vemos en la tabla periódica se calcula de acuerdo con este fenómeno.
Podemos usar los siguientes dos pasos para este cálculo;
- Primero, convierta los porcentajes en valores decimales dividiéndolos con 100.
- Luego, multiplique las masas atómicas de cada isótopo a partir de estos valores decimales en consecuencia.
- Por fin, agregue las respuestas juntas para obtener la respuesta final.
Video 1: Calcular el peso atómico
Ejemplo: Supongamos que tenemos el 98% de los isótopos C-12 y el 2% del isótopo C-13 en la naturaleza. Calculemos el peso atómico del carbono utilizando las masas atómicas de estos isótopos.
- Convertir en valores decimales:
- El valor decimal para el porcentaje de C-12 es 0.98 (obtenido dividiendo 98 de 100).
- El valor decimal para el porcentaje de C-13 es 0.02 (obtenido dividiendo 2 de 100).
- Multiplicación de masas atómicas de cada isótopo a partir de los valores decimales:
- 12 x 0.98 = 11.76
- 13 x 0.02 = 0.26
- Adición de respuestas juntos para obtener la respuesta final:
- 76 + 0.26 = 12.02
Finalmente, podemos obtener el peso atómico del elemento químico de carbono como 12.02 AMU (unidades de masa atómica). Además, podemos nombrar este término como "masa atómica relativa" porque es un promedio de masas atómicas reales de isótopos.
¿Qué es la masa atómica??
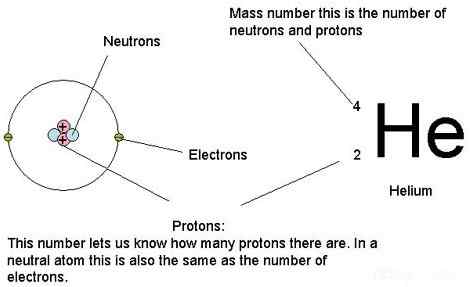
Los átomos contienen principalmente protones, neutrones y electrones. La masa atómica es simplemente la masa de un átomo. En otras palabras, es la colección de masas de todos los neutrones, protones y electrones en un solo átomo, específicamente, cuando el átomo no se mueve (masa de descanso). Tomamos solo la masa del resto porque, según los fundamentos de la física, cuando los átomos se mueven a una velocidad muy alta, las masas aumentan. Sin embargo, la masa de electrones es considerablemente muy pequeña en comparación con las masas de protones y neutrones. Por lo tanto, podemos decir que la contribución de los electrones a una masa atómica es menor. Por lo tanto, podemos descuidar la masa de un electrón al calcular la masa atómica. Sobre todo, diferentes isótopos tienen diferentes masas atómicas, aunque pertenecen al mismo elemento químico porque tienen diferentes números de neutrones.

Figura 01: Podemos usar las masas de protones, neutrones y electrones de un átomo para calcular la masa atómica
Además, las masas de átomos son extremadamente pequeñas, por lo que no podemos expresarlas en unidades de masa normales como gramos o kilogramos. Para nuestros propósitos, estamos utilizando otra unidad de masa atómica de la unidad (AMU) para medir la masa atómica. Del mismo modo, 1 Unidad de masa atómica es la vigésima parte de la masa de un isótopo C-12. Cuando dividimos una masa de un átomo de la masa de una duodécima parte de la masa de un isótopo C-12, podemos obtener su masa relativa. Sin embargo, en el uso general cuando decimos la masa atómica relativa de un elemento, nos referimos a su peso atómico (porque lo calculamos considerando todos los isótopos).
¿Cuál es la diferencia entre el peso atómico y la masa atómica??
La mayoría de las veces usamos los términos peso atómico y masa atómica como la misma. Sin embargo, estos dos términos difieren entre sí principalmente según la definición. Por lo tanto, con la definición, la diferencia clave entre el peso atómico y la masa atómica es que el peso atómico es el peso promedio de un elemento, con respecto a todos sus isótopos y sus abundancias relativas, mientras que la masa atómica es la masa de un solo átomo.
Además, podemos identificar otra diferencia importante entre el peso atómico y la masa atómica al considerar la forma de calcular cada valor; Debemos calcular el peso atómico utilizando el porcentaje de abundancia de todos los isótopos de un elemento químico en la naturaleza, mientras que podemos calcular la masa atómica simplemente agregando las masas de protones, neutrones y electrones de un átomo.
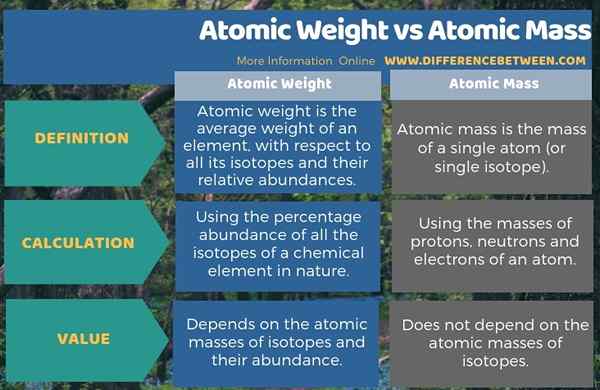
Resumen -Peso atómico vs masa atómica
El peso atómico y la masa atómica son dos términos importantes que a menudo usamos en los cálculos químicos. La diferencia clave entre el peso atómico y la masa atómica es que el peso atómico es el peso promedio de un elemento, con respecto a todos sus isótopos y sus abundancias relativas, mientras que la masa atómica es la masa de un solo átomo.
Referencia:
1. Wichers, Edward y H. Steffen Peiser. "Peso atomico."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 15 de diciembre. 2017. Disponible aquí
2. Helmenstine, Anne Marie, PH.D. "Cómo calcular la masa atómica."Thinkco, abril. 1, 2018. Disponible aquí
Imagen de cortesía:
1."133317385" por Elearn.Punjab (CC0) a través de Vimeo
2."Representación de números atómicos" por MaterialScientist (CC0) a través de Commons Wikimedia


