Diferencia entre la autoionización y la autoprotólisis
El diferencia clave entre la autoionización y la autoprotólisis es que La autoionización es la conversión de un estado neutral de una especie química en un estado ionizado, mientras que la autoprotólisis es la transferencia de un protón entre dos especies químicas idénticas para formar formas ionizadas.
Ambos términos autoionización y autoprotólisis describen los dos métodos de formación de especies ionizadas, i.mi. cationes y aniones. Estas son reacciones espontáneas donde la ionización ocurre sin el efecto de un factor externo.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la autoionización?
3. ¿Qué es la autoprotólisis?
4. Comparación de lado a lado: autoionización frente a autoprotólisis en forma tabular
5. Resumen
¿Qué es la autoionización??
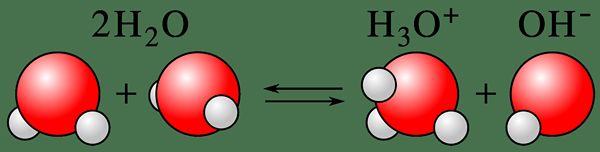
La autoionización es el proceso de convertir un estado neutral de una especie química en un estado ionizado. El término generalmente describe la ionización de las moléculas de agua. Por lo tanto, podemos llamarlo autoionización del agua o auto-disociación del agua también. Aquí, una molécula de agua se desprotona para formar un ion hidróxido, OH- y un ion hidrógeno, H+ (un protón). Aquí, la desprotonación protona inmediatamente otra molécula de agua y conduce a la formación de un ion hidronio (H3O+). Entonces, este proceso es un buen ejemplo de la naturaleza anfotérica del agua.

Figura 01: Autoionización de una molécula de agua
Además, este proceso describe la naturaleza anfotérica del agua. La naturaleza anfotérica significa que el agua puede actuar como ácido y base porque la autoionización forma protones e iones de hidróxido, lo que le da al agua la capacidad de neutralizar tanto los ácidos como las bases; por ejemplo, ion hidronio o h3O+ El ion puede neutralizar bases suaves, y los iones de hidróxido pueden neutralizar los ácidos suaves.
¿Qué es la autoprotólisis??
La autoprotólisis es el proceso de transferencia de un protón entre especies químicas idénticas para formar especies ionizadas. Aquí, una de las dos moléculas idénticas actúa como el ácido Brønsted, y libera un protón. La otra molécula puede aceptar este protón. Por lo tanto, esta otra molécula actúa como la base de Brønsted. La auto ionización del agua es un ejemplo para la autoprotólisis. Además, este término es diferente de la autoprotonólisis porque la autoprotonólisis describe la escisión de un enlace químico por los ácidos.
Algunos otros ejemplos de compuestos químicos que sufren autoprotólisis incluyen amoníaco y ácido acético;
Autoprotólisis de amoníaco:
2NH3 ⇌ NH2- + NUEVA HAMPSHIRE4+
Autoprotólisis del ácido acético:
2ch3COOH ⇌ CH3ARRULLO- + Pez3Cooh2+
¿Cuál es la diferencia entre la autoionización y la autoprotólisis??
Tanto la autoionización como la autoprotólisis son reacciones espontáneas. La diferencia clave entre la autoionización y la autoprotólisis es que la autoionización es la conversión de un estado neutral de una especie química en un estado ionizado, mientras que la autoprotólisis es la transferencia de un protón entre dos especies químicas idénticas para formar formas ionizadas. Un ejemplo de autoionización es el agua, mientras que el agua, el amoníaco y el ácido acético son algunos ejemplos para la autoprotólisis.
Además, en el proceso de autoionización (también conocido como autoionización del agua o auto-disociación), una molécula de agua se desprotona para formar un ion hidróxido, OH y un ion de hidrógeno, H+ (un protón), mientras que en el proceso de proceso de Autoprotólisis, una de las dos moléculas idénticas involucradas actúa como el ácido Brønsted y libera un protón que es aceptado por la otra molécula que actúa como la base de Brønsted. Además, el proceso de autoionización del agua describe la naturaleza anfotérica (puede neutralizar los ácidos suaves y las bases suaves) de agua. Por otro lado, la autoprotólisis describe la naturaleza anfotérica de los compuestos químicos como el agua, el ácido acético y el amoníaco.
La siguiente infografía resume la diferencia entre la autoionización y la autoprotólisis.
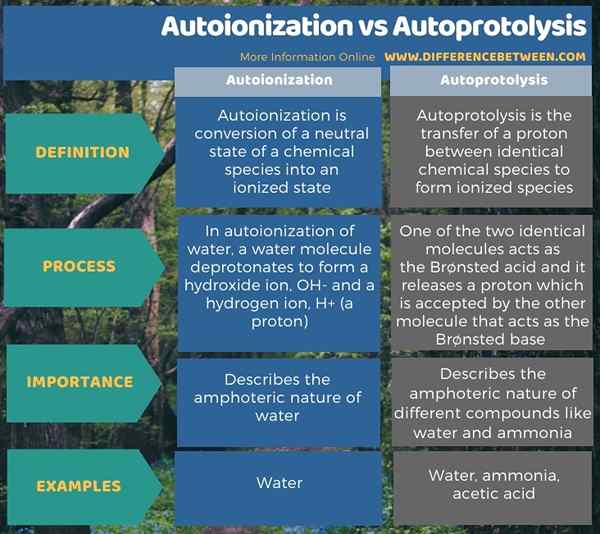
Resumen -Autoionización vs autoprotólisis
Tanto la autoionización como la autoprotólisis son reacciones espontáneas. La diferencia clave entre la autoionización y la autoprotólisis es que la autoionización es la conversión de un estado neutral de una especie química en un estado ionizado, mientras que la autoprotólisis es la transferencia de un protón entre dos especies químicas idénticas para formar formas ionizadas.
Referencia:
1. "Autodionización del agua."Wikipedia, Fundación Wikimedia, 3 de junio de 2019, disponible aquí.
2. "Autoprotólisis."Wikipedia, Fundación Wikimedia, 24 de septiembre. 2019, disponible aquí.
3. "Autoionización de agua."Bibliotecas de química, Librettexts, 5 de junio de 2019, disponible aquí.
Imagen de cortesía:
1. "AutoProtolyse Eau" de Cdang - Trabajo propio (dominio público) a través de Commons Wikimedia


