Diferencia entre la destilación azeotrópica y extractiva
Diferencia clave: azeotrópico vs Extractivo Destilación
El diferencia clave entre la destilación azeotrópica y extractiva es que en destilación azeotrópica, Se requiere la formación de un azeótropo para separar los componentes de una mezcla, mientras que, en destilación extractiva, no tiene lugar la formación de azeótropo.
La destilación es el proceso de purificar un líquido mediante un proceso de calentamiento y enfriamiento. En la destilación azeotrópica, se forma un azeótropo antes de la separación de componentes de una mezcla. Un azeótropo es una mezcla de componentes que tienen un punto de ebullición constante. En el proceso de destilación extractiva, no hay necesidad de formar un azeótropo. En ese método, se agrega un tercer componente a una mezcla binaria. Este tercer componente puede afectar la volatilidad de los componentes existentes.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la destilación azeotrópica?
3. ¿Qué es la destilación extractiva?
4. Comparación lado a lado: destilación azeotrópica frente a extractiva en forma tabular
5. Resumen
¿Qué es la destilación azeotrópica??
La destilación azeotrópica es una técnica de separación utilizada para separar los componentes de una mezcla formando un azeotrope. Los azeótropos son mezclas de componentes con un punto de ebullición constante. Este tipo de mezcla no se puede separar en componentes por destilación simple ya que todos los componentes tienen el mismo punto de ebullición. Cuando se hierve una mezcla azeotrópica, la proporción de componentes en el líquido y su fase de vapor es igual.
En el método de destilación azzeotrópica, se agrega un nuevo componente (conocido como ingreso) a la mezcla azeotrópica para formar un nuevo azeótropo que hierve a una temperatura más baja que la azeótropo existente. Luego, el sistema tiene dos fases líquidas inmiscibles con diferentes puntos de ebullición (heterogéneos).

Figura 01: El sistema de separar el etanol (E) del agua (W) usando benceno (B)
Por ejemplo, consideremos una mezcla de etanol y agua. Se conoce como un azeótropo binario Porque hay dos componentes miscibles en la mezcla. Si se agrega benceno como intravenador de esta mezcla, puede afectar la volatilidad de otros componentes en la mezcla. La mezcla ahora se llama azeótropo terciario ya que hay tres componentes en la mezcla. Cuando esta mezcla se destila, se conoce como destilación azeotrópica.
¿Qué es la destilación extractiva??
La destilación extractiva es una técnica de separación que incluye la adición de un tercer componente a una mezcla binaria para permitir la separación de los dos componentes. Sin embargo, el tercer componente no se vaporiza durante el proceso de destilación; El tercer componente debe ser menos volátil. O bien, debe tener un punto de ebullición más alto.
Si la mezcla binaria tiene dos componentes con puntos de ebullición relativamente similares, entonces estos componentes no se pueden separar mediante destilación simple. Esto sucede ya que ambos componentes se vaporizarán a temperaturas casi similares (mala resolución).
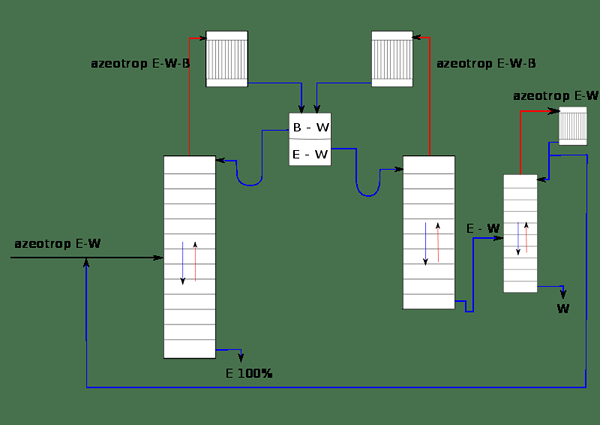
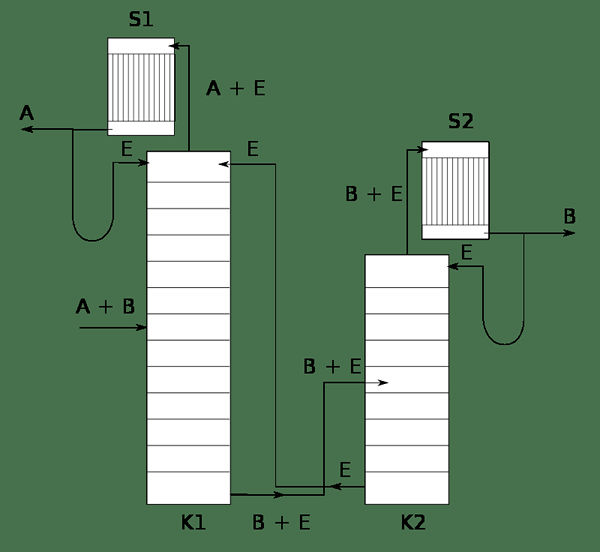
Figura 02: Un sistema que muestra la destilación extractiva de la mezcla A y B usando E solvente
Durante el proceso de destilación extractiva, no se forma un azeótropo. El proceso implica un disolvente con una volatilidad muy baja como el disolvente de la mezcla de componentes. Se conoce como el solvente de separación. Durante la destilación, el componente con la mayor volatilidad se vaporizará fácilmente como el producto superior. El resto es el disolvente y el otro componente (en la mezcla binaria). Dado que el disolvente no forma un azeótropo con el segundo componente, también se puede separar fácilmente con un método disponible.
Por ejemplo, la extracción de tolueno de parafina se puede hacer en el método de destilación extractiva. La mezcla de tolueno e iso-octano tiene pesos moleculares casi similares. Por lo tanto, la separación de tolueno de esta mezcla es muy difícil. Pero cuando se agrega fenol a esta mezcla, aumenta el punto de ebullición del iso-octano. Esto hace que sea fácil separar el tolueno de esta mezcla.
¿Cuál es la diferencia entre la destilación azeotrópica y extractiva??
Destilación azeotrópica vs extractiva | |
| La destilación azeotrópica es una técnica de separación utilizada para separar los componentes de una mezcla formando un azeotrope. | La destilación extractiva es una técnica de separación que incluye la adición de un tercer componente a una mezcla binaria para permitir la separación de los dos componentes. |
| Técnica | |
| En la técnica de destilación azeotrópica, la formación de un azeótropo antes de la destilación es importante. | En la técnica de destilación extractiva, se agrega un componente no volátil a la mezcla que puede afectar la volatilidad de los componentes en la mezcla. |
| Separación | |
| La destilación azeotrópica separa un componente en la fase de vapor que tiene la misma composición química que en la fase líquida. | La destilación extractiva separa un componente de una matriz de sustancias. |
Resumen - Azeotrópico vs Extractivo Destilación
La destilación es una técnica química utilizada para la separación de diferentes componentes en una mezcla. Hay muchos tipos de técnicas de destilación, la destilación simple es el tipo más simple. La destilación azeotrópica y la destilación extractiva son dos tipos importantes de destilación. La diferencia entre la destilación azeotrópica y extractiva es que se requiere la formación de un azeótropo para separar los componentes de una mezcla, mientras que, en destilación extractiva, no tiene lugar la formación de azeótropo.
Referencia:
1. "Destilación azeotrópica."Wikipedia, Fundación Wikimedia, 4 de abril. 2018. Disponible aquí
2. "Destilación extractiva."Wikipedia, Fundación Wikimedia, 14 de enero. 2018. Disponible aquí
3. "Azeotrope."Wikipedia, Fundación Wikimedia, 8 de abril. 2018. Disponible aquí
Imagen de cortesía:
1.'Distil Extract'by Joanna Kośmider - Trabajo propio, (dominio público) a través de Commons Wikimedia
2.'Azeotr Distill2'by Joanna Kośmider - Trabajo propio, (dominio público) a través de Commons Wikimedia


