Diferencia entre la unión posterior y la unión coordinada
El diferencia clave entre la unión trasera y la unión de coordenadas es que La unión posterior se refiere a un enlace químico que se forma entre un orbital atómico de un átomo y un orbital antibonding de un ligando, mientras que la unión de coordenadas se refiere al intercambio de un par de electrones entre una especie electronegativa y una especie electroficiente.
Los enlaces de coordenadas ocurren comúnmente en los complejos de coordinación en los que un átomo de metal central está rodeado por un conjunto de ligandos, que se unen al átomo de metal a través de enlaces de coordenadas. Aquí, los ligandos comparten sus pares de electrones solitarios con el átomo de metal. Pero, en la unión posterior, se forma un enlace químico entre un orbital atómico de un átomo y un orbital antibondante de otro átomo cuando tienen simetrías equivalentes. En la química organometálica, este tipo de enlaces químicos es común.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la unión?
3. ¿Qué es la unión coordinada?
4. Comparación de lado a lado: unión de enlace posterior versus unión de coordenadas en forma tabular
5. Resumen
¿Qué es la unión??
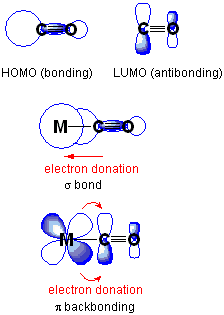
La unión posterior o el enlace PI-Back es una situación en la que los electrones de un orbital atómico de un átomo se mueven a un orbital antibonding de otro átomo, formando un enlace químico. Aquí, las dos formas de orbitales deben tener una simetría apropiada. Por lo general, el átomo con el orbital atómico es un metal de transición, mientras que el átomo con el orbital antibondante es parte de un ligando PI-aceptador. En la química organometálica, este tipo de enlace químico es común y tiene metales de transición complejados con ligandos multiatómicos, E.gramo., monóxido de carbono, etileno, ion nitrosonio.

Figura 01: Donación posterior
Además, la vinculación posterior es un proceso sinérgico. Implica la donación de electrones de un orbital que se llena con electrones o que contiene un par de electrones solitario en un orbital vacío del metal de transición, junto con la liberación de electrones de un orbital de metal en un orbital antibondante del ligando.
¿Qué es la unión coordinada??
La unión de coordenadas se refiere a un enlace covalente en el que uno de los dos átomos proporciona los electrones de enlace compartido en el enlace. Eso significa; Un átomo dona uno de sus pares de electrones solitarios a otro átomo, y el par solitario de electrones se comparte entre los dos átomos a partir de entonces. Como es una donación, podemos nombrarlo como un enlace dativo o unión dipolar también.
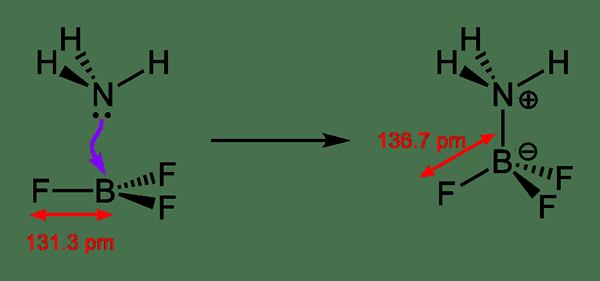
Figura 02: un proceso de formación de enlaces dativos
Al dibujar las estructuras químicas, podemos mostrar el enlace de coordenadas usando una flecha; La punta de flecha muestra qué átomo aceptó electrones y la cola de flecha comienza desde el átomo que donó el par de electrones. Sin embargo, también es un tipo de enlace covalente; Por lo tanto, reemplazamos esta flecha con una línea habitual para demostrar que es un enlace donde se comparte un par de electrones. Estos enlaces se encuentran comúnmente en complejos de coordinación donde un ion metálico acepta pares de electrones solitarios de los ligandos.
¿Cuál es la diferencia entre la unión trasera y la unión de coordenadas??
La unión posterior y la unión de coordenadas son dos enlaces covalentes diferentes. La diferencia clave entre la unión posterior y la unión de coordenadas es que la unión posterior se refiere al enlace químico que se forma entre un orbital atómico de un atómico y un orbital antibonding de un ligando, mientras que la unión coordinada se refiere al intercambio de un par de electrones entre una especie electronegativa y una especie electroeficiente.
Debajo de la infografía informa la diferencia entre la unión posterior y la unión de coordenadas.
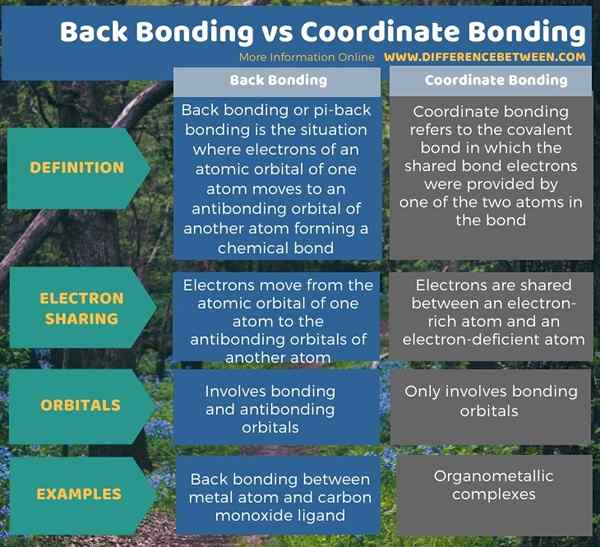
Resumen -Back Bonding vs COORDINACIÓN VIDA
La unión posterior y la unión de coordenadas son dos formas diferentes de enlaces covalentes. La diferencia clave entre la unión posterior y la unión de coordenadas es que la unión posterior se refiere al enlace químico que se forma entre un orbital atómico de un atómico y un orbital antibonding de un ligando, mientras que la unión coordinada se refiere al intercambio de un par de electrones entre una especie electronegativa y una especie electroeficiente.
Referencia:
1. Helmenstine, Anne Marie. "Definición de enlace dativo (enlace coordinado)."Thinkco, octubre. 14, 2019, disponible aquí.
Imagen de cortesía:
1. "Back Bonding" de OMCV - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "NH3-BF3-Aducto-Bond-Lenging-2D" por Ben Mills-Trabajo propio (dominio público) a través de Commons Wikimedia


