Diferencia entre la ecuación equilibrada y la ecuación iónica neta

Diferencia clave: ecuación equilibrada vs ecuación iónica neta
Todas las reacciones químicas se pueden escribir como una ecuación. Los componentes de esta ecuación incluyen reactivos con sus estados físicos, una flecha para mostrar la dirección de reacción y los productos de reacción con sus estados físicos. Si se utilizaron las condiciones especiales, también se escriben brevemente en la flecha. Si la reacción está en equilibrio, se usan dos medias flechas en direcciones opuestas. Una ecuación química se puede escribir de dos maneras: como ecuación equilibrada o como una ecuación iónica neta. La diferencia clave entre la ecuación equilibrada y la ecuación iónica neta es que La ecuación equilibrada muestra todas las reacciones que tuvieron lugar en un sistema juntos mientras La ecuación iónica neta solo muestra la reacción neta que ocurrió después de la finalización de esa reacción particular.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es una ecuación equilibrada?
3. ¿Qué es una ecuación iónica neta?
4. Comparación de lado a lado: ecuación equilibrada vs ecuación iónica neta
5. Resumen
¿Qué es una ecuación equilibrada??
Las reacciones químicas son muy importantes para comprender el comportamiento de un sistema en particular. Al escribir la ecuación correcta para la reacción, se puede tener una idea sobre los cambios de diferentes especies en ese sistema. Para reacciones simples como la disolución de NaCl en el agua, la ecuación se puede escribir fácilmente mediante la predicción de los posibles productos de esa reacción. Pero para otras reacciones complejas, pueden tener que realizar más pruebas para descubrir los productos de ese sistema en particular. Pero la mayoría de las veces, es muy probable que la ecuación escrita esté desequilibrada, lo que dificulta explicar el comportamiento químico de ese sistema. Por lo tanto, las ecuaciones desequilibradas también deben estar equilibradas. La ecuación equilibrada incluye todos los reactivos y productos de ese sistema. La ecuación se escribe considerando el compuesto reactivo como una molécula. Por ejemplo, la ecuación equilibrada entre KI y PBNO3 (Si se reaccionara en agua) sería;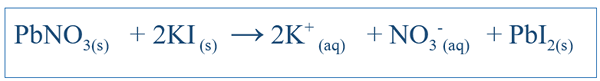
La importancia de una ecuación equilibrada es que revela las cantidades de reactivos que deben agregarse dando detalles sobre las relaciones estequiométricas entre la especie en el sistema. En el ejemplo anterior, la relación entre pbno3 y Ki debe ser 1: 2 al agregar esos componentes al sistema.
¿Qué es una ecuación iónica neta??
La ecuación iónica neta muestra solo la reacción general que ha tenido lugar en el sistema. Incluye las especies iónicas y los productos formados. Pero no indica todas las reacciones que han sucedido en un sistema particular. Por ejemplo, si hay una reacción entre dos moléculas que usan agua como medio, los compuestos pueden haberse disuelto en agua y separados en iones. Algunos de estos iones pueden estar involucrados en la reacción, pero algunos no pueden. Entonces la ecuación iónica neta incluye solo los iones que participaron en una reacción neta. Otros iones, que se llaman iones espectadores, se eliminan de la ecuación para obtener la ecuación iónica neta. Por ejemplo, si Ki y Pbno3 reaccionado en agua, la reacción iónica neta sería;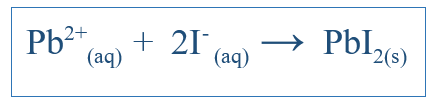
Esto también debería incluir K+ ion y no3- ion, pero esos iones solo se disolverán y no participarán en la reacción principal; Por lo tanto, no están incluidos en la reacción iónica neta.
¿Cuál es la diferencia entre la ecuación equilibrada y la ecuación iónica neta??
Ecuación equilibrada vs ecuación iónica neta | |
| Todos los componentes que se usaron se escriben como reactivos en la ecuación equilibrada. | Los reactivos que solo estaban involucrados en la reacción neta se escribirían en la reacción iónica neta. |
| Productos | |
| Todos los componentes al final de la reacción se incluyen en una ecuación equilibrada. | En una ecuación iónica neta, solo se escribe el producto final neto. |
| Detalles dados | |
| La ecuación equilibrada dará detalles sobre todas las especies que se encuentran en el sistema. | La ecuación iónica neta solo da detalles sobre especies que participaron en la reacción |
Resumen - Ecuación equilibrada vs ecuación iónica neta
Cuando ciertos compuestos iónicos se agregan al agua, se separan y forman iones que se disuelven en agua. Esto produce aniones y cationes. Para mostrar las especies producidas después de la finalización de la reacción y la dirección de la reacción, se puede escribir una ecuación química. Esta ecuación puede equilibrarse considerando el número de átomos de cada especie que residen en los dos lados de la flecha; A veces, incluso la carga de esas especies debe considerarse. Esto proporciona una ecuación química equilibrada para ese sistema en particular. Sin embargo, la ecuación iónica neta incluye solo la especie reaccionada. Como se señaló anteriormente, la diferencia clave entre la ecuación equilibrada y la ecuación iónica neta es que la ecuación equilibrada muestra todas las reacciones en un sistema, mientras que la ecuación iónica neta muestra solo la reacción neta que tuvo lugar al finalizar la reacción particular.
Referencias:
1. Chang, R., 2010. química. 10ª ed. Newyork: McGraw-Hill.
2. Reacciones químicas. (norte.d.). Consultado el 26 de mayo de 2017 de http: // www.rico.edu/facultad/ptiskus/reacciones/
3. Ecuaciones iónicas e iónicas completas. (norte.d.). Consultado el 26 de mayo de 2017 de https: // www.academia Khan.org/Science/Chemistry/Chemical-Reactions-Stoichiome/Tipos de reacciones químicas/a/a iónica y red-iónica.


