Diferencia entre la ecuación equilibrada y la ecuación de esqueleto
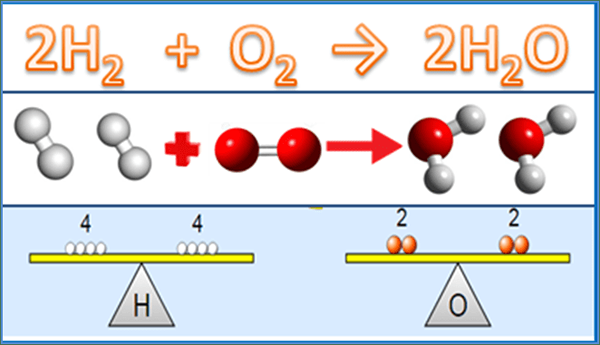
La diferencia clave entre la ecuación equilibrada y la ecuación del esqueleto es que La ecuación equilibrada proporciona el número real de moléculas de cada reactivo y el producto involucrado en la reacción química, mientras que la ecuación del esqueleto da solo los reactivos de la reacción.
Una ecuación química es una representación de una reacción química. Eso significa; La ecuación química proporciona los reactivos de la reacción, el producto final y la dirección de la reacción también. Hay dos tipos de ecuaciones como ecuación equilibrada y ecuación de esqueleto.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es una ecuación equilibrada?
3. ¿Qué es una ecuación de esqueleto?
4. Comparación lado a lado: ecuación equilibrada vs ecuación de esqueleto en forma tabular
5. Resumen
¿Qué es una ecuación equilibrada??
Una ecuación química equilibrada proporciona el número real de cada reactivo que reaccionan entre sí y el número de moléculas de producto formadas. Es una ecuación completamente detallada que da las relaciones entre reactivos y productos. Al calcular un parámetro como la cantidad de producto que obtenemos de la reacción, tenemos que usar la ecuación química equilibrada; De lo contrario, no sabremos cuánto reaccionaron los reactivos para dar cuánto del producto.

Sin embargo, en los cálculos termodinámicos, esta ecuación no funciona al determinar el orden de reacción porque tenemos que determinar el orden de reacción esencialmente a través de un método experimental. En una ecuación química equilibrada, los valores frente a la molécula se denominan "coeficiente estequiométrico"; La estequiometría es la relación numérica entre reactivos y productos.
2NA2O ⟶ 4NA +O2
La reacción anterior es un ejemplo de una ecuación química equilibrada. Da la descomposición del óxido de sodio (na2O). La ecuación normal o la ecuación esquelética de esta reacción es NA2O ⟶ na + o2. Al equilibrar la ecuación, podemos usar dos métodos: método de inspección y el método de número de oxidación.
El método de inspección incluye equilibrar la ecuación química observando los reactivos y productos. En esta reacción, el óxido de sodio es el reactivo, y tiene dos átomos de sodio y un átomo de oxígeno por molécula. Pero en el lado del producto, hay un átomo de sodio y dos átomos de oxígeno. Por lo tanto, primero, podemos agregar un coeficiente estequiométrico al lado reactivo; Es 2. Luego, en el lado reactivo, hay cuatro átomos de sodio y dos átomos de oxígeno. Dado que también hay dos átomos de oxígeno en el lado del producto, solo podemos agregar "4" como el coeficiente estequiométrico de sodio en el lado del producto para equilibrar esta ecuación. Ahora el número de átomos en cada lado es igual; Por lo tanto, obtenemos una ecuación química equilibrada.
¿Qué es una ecuación de esqueleto??
La ecuación del esqueleto proporciona los tipos de reactivos involucrados en la reacción química y los productos finales. Sin embargo, esto no da la relación exacta entre los reactivos y los productos. Por lo tanto, los detalles importantes que podemos obtener de una ecuación de esqueleto son los reactivos de la reacción, los productos de la reacción y la dirección de la reacción. Para la reacción anterior, la reacción del esqueleto es la siguiente;
N / A2O ⟶ na +o2
¿Cuál es la diferencia entre la ecuación equilibrada y la ecuación del esqueleto??
La diferencia clave entre la ecuación equilibrada y la ecuación del esqueleto es que la ecuación equilibrada proporciona el número real de moléculas de cada reactivo y el producto involucrado en la reacción química, mientras que la ecuación del esqueleto da solo los reactivos de la reacción. Además, una ecuación equilibrada puede o no contener coeficientes estequiométricos, mientras que una ecuación de esqueleto no tiene coeficientes estequiométricos. Por ejemplo, la ecuación química equilibrada para la descomposición del óxido de sodio es 2NA2O ⟶ 4NA + O2 mientras que la ecuación del esqueleto es NA2O ⟶ na + o2.
La siguiente infografía resume la diferencia entre la ecuación equilibrada y la ecuación del esqueleto.

Resumen -Ecuación equilibrada vs ecuación de esqueleto
La ecuación equilibrada y la ecuación del esqueleto son dos formas de escribir una ecuación química para una reacción química particular. En resumen, la diferencia clave entre la ecuación equilibrada y la ecuación del esqueleto es que la ecuación equilibrada proporciona el número real de moléculas de cada reactivo y el producto involucrado en la reacción química, mientras que la ecuación del esqueleto da solo los reactivos de la reacción de la reacción.
Referencia:
1. Helmenstine, Anne Marie. “Definición y ejemplos de ecuaciones equilibradas."Thinkco, sep. 17, 2019, disponible aquí.
Imagen de cortesía:
1. "Equilibrio de ecuación química - Formación de agua" por KVR.Lohith - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia


