Diferencia entre la base y el nucleófilo
El diferencia clave entre la base y el nucleófilo es que Las bases son aceptores de hidrógeno que pueden realizar reacciones neutralizantes, mientras que los nucleófilos atacan a los electrofilos para iniciar algunas reacciones orgánicas.
Los ácidos y las bases son dos conceptos importantes en la química. Ambos tienen propiedades contradictorias. Un nucleófilo es un término, que usamos de manera más prominente en la química orgánica para describir los mecanismos y tasas de reacción. Estructuralmente, no hay una diferencia distinguida entre la base y el nucleófilo, pero funcionan funcionalmente.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es la base
3. ¿Qué es el nucleófilo?
4. Comparación de lado a lado - Base vs nucleófilo en forma tabular
5. Resumen
Que es la base?
Podemos definir bases de varias maneras de acuerdo con las definiciones de varios científicos. Arrhenius define una base como una sustancia que dona- iones a la solución. Según Lewis, cualquier donante de electrones es una base. Bronsted-Lowry define una base como una sustancia que puede aceptar un protón. Según la definición de Arrhenius, un compuesto debe tener un anión hidróxido y la capacidad de donarlo como un ion hidróxido para ser una base.
Sin embargo, según las teorías de Lewis y Bronsted-Lowry, hay algunas moléculas, que no poseen hidróxidos pero pueden actuar como base. Por ejemplo, NH3 es una base de Lewis, porque puede donar el par de electrones en nitrógeno. Del mismo modo, na2CO3 es una base de bronsted-lowry sin grupos de hidróxido, pero tiene la capacidad de aceptar hidrógenos.

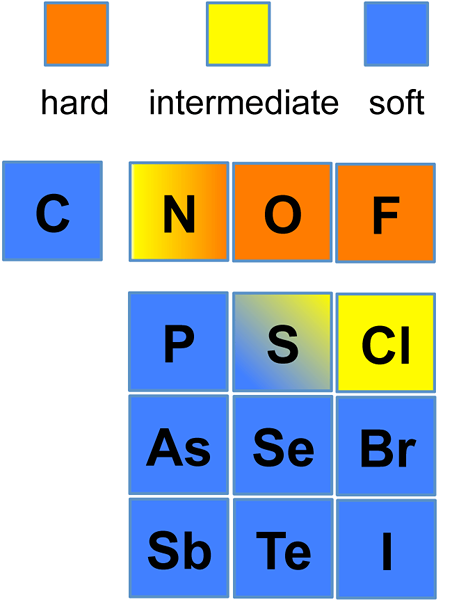
Figura 01: Elementos químicos en la tabla periódica que pueden formar compuestos básicos duros, suaves e intermedios
Propiedades de las bases
Las bases tienen un jabón resbaladizo como la sensación y un sabor amargo. Reaccionan fácilmente con ácidos que producen agua y moléculas de sal. Los refrescos cáusticos, el amoníaco y el bicarbonato de sodio son algunas de las bases comunes que nos encontramos muy a menudo. Podemos clasificar las bases en dos categorías, dependiendo de su capacidad para disociar y producir iones de hidróxido. Bases fuertes como NaOH, KOH puede sufrir una ionización completa en una solución para dar iones. Bases débiles como NH3 se disocian parcialmente y dan menos cantidades de iones de hidróxido.
Kb es la constante de disociación base. Da una indicación de la capacidad de perder iones de hidróxido de una base débil. Ácidos con un PK más altoa El valor (más de 13) son ácidos débiles, pero sus bases conjugadas se consideran bases fuertes. Para verificar si una sustancia es una base o no, podemos usar varios indicadores como papel de fuego o papel de pH. Las bases muestran un valor de pH superior a 7, y se convierte en rojo en azul.
¿Qué es un nucleófilo??
Podemos nombrar cualquier ion negativo o cualquier molécula neutra que tenga al menos un par de electrones no compartido como nucleófilo. El nucleófilo es una sustancia que es muy electropositiva, por lo tanto, como interactuar con centros positivos. Puede iniciar reacciones utilizando el par de electrones solitarios. Por ejemplo, cuando un nucleófilo reacciona con un haluro de alquilo, el par solitario del nucleófilo ataca el átomo de carbono que lleva el halógeno. Este átomo de carbono tiene una carga positiva parcial debido a la diferencia de electronegatividad entre el átomo de carbono y el átomo de halógeno.
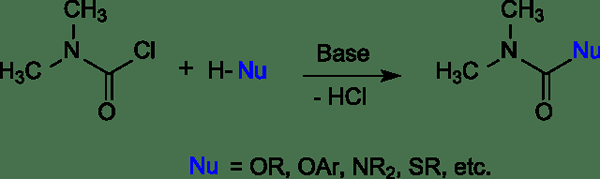
Figura 02: Reacciones del cloruro de dicarbamoil con nucleófilos
Después de que el nucleófilo se une al carbono, el halógeno deja. Llamamos a este tipo de reacciones como reacciones de sustitución nucleófila. Hay otro tipo de reacciones que se inicia con los nucleófilos; Son reacciones de eliminación nucleofílica. La nucleofilicidad cuenta sobre los mecanismos de reacción. Por lo tanto, es una indicación de las velocidades de reacción. Por ejemplo, si la nucleofilicidad es alta, entonces una determinada reacción puede ocurrir rápido, y si la nucleofilicidad es baja, la velocidad de reacción es lenta. Dado que los nucleófilos donan electrones, según la definición de Lewis, son bases.
¿Cuál es la diferencia entre la base y el nucleófilo??
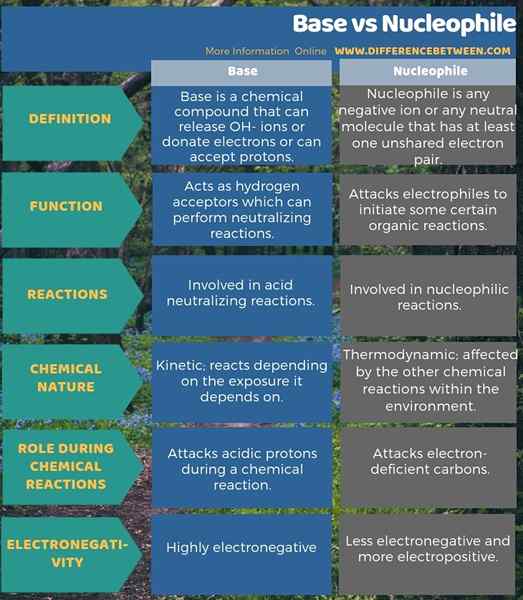
La principal diferencia entre la base y el nucleófilo se encuentra en su función. Las bases son aceptores de hidrógeno que pueden realizar reacciones neutralizantes, mientras que los nucleófilos atacan a los electrofilos para iniciar algunas reacciones orgánicas. Por lo tanto, esta es la diferencia clave entre la base y el nucleófilo. Además, las bases actúan como aceptores de hidrógeno que pueden realizar reacciones neutralizantes, mientras que los nucleófilos atacan a los electrofilos para iniciar algunas reacciones orgánicas.
Como otra diferencia importante entre la base y el nucleófilo, podemos tomar el tipo de reacciones químicas en las que implican; Las bases implican en reacciones neutralizantes de ácido, mientras que los nucleófilos involucran en reacciones nucleófilas. Además, las bases tienen una naturaleza química cinética, lo que significa que reaccionan dependiendo de la exposición de la que depende. Sin embargo, los nucleófilos tienen una naturaleza química termodinámica, lo que significa que se ven afectados por las otras reacciones químicas dentro del medio ambiente.
Resumen -Base vs nucleófilo
Cada nucleófilo es una base, pero todas las bases no son nucleófilos. La diferencia clave entre la base y el nucleófilo es que las bases son aceptores de hidrógeno que pueden realizar reacciones neutralizantes, mientras que los nucleófilos atacan a los electrofilos para iniciar algunas reacciones orgánicas.
Referencia:
1. Britannica, los editores de Encyclopedia. "Base."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 27 de diciembre. 2017. Disponible aquí
2. Bibliotecas. "Nucleófilo."Bibliotecas de química, National Science Foundation, 7 de junio de 2018. Disponible aquí
Imagen de cortesía:
1."HardsoftBases" de TEM5PSU - Trabajo propio, (CC BY -SA 3.0) a través de Commons Wikimedia
2."DMCC-Reaktion MIT Nukleophilen" por ChemDoc 2010-Trabajo propio, (CC BY-SA 4.0) a través de Commons Wikimedia


