Diferencia entre BCC y FCC
Diferencia clave: BCC vs FCC
Los términos BCC y FCC se utilizan para nombrar dos disposiciones diferentes de estructuras cristalinas. BCC significa estructura cúbica centrada en el cuerpo mientras que la FCC representa estructura cúbica centrada en la cara. Estas son formas de redes cúbicas. Por lo tanto, estas arreglos tienen esferas (átomos, moléculas o iones de los cuales está hecha la red) dispuestas en estructuras cúbicas. La celda unitaria de BCC tiene esferas en las esquinas de un cubo y una esfera en el centro del cubo. Dado que hay ocho esquinas en un cubo, el número total de esferas presentes en una celda unitaria BCC es 9. La celda unitaria de la FCC tiene esferas en cada esquina de un cubo y también en el centro de cada cara cúbica. Entonces la celda unitaria de la FCC tiene 12 esferas. El diferencia clave entre BCC y FCC es que El número de coordinación de BCC es 8, mientras que el número de coordinación de FCC es de 12.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es BCC?
3. ¿Qué es la FCC?
4. Similitudes entre BCC y FCC
5. Comparación lado a lado: BCC vs FCC en forma tabular
6. Resumen
¿Qué es BCC??
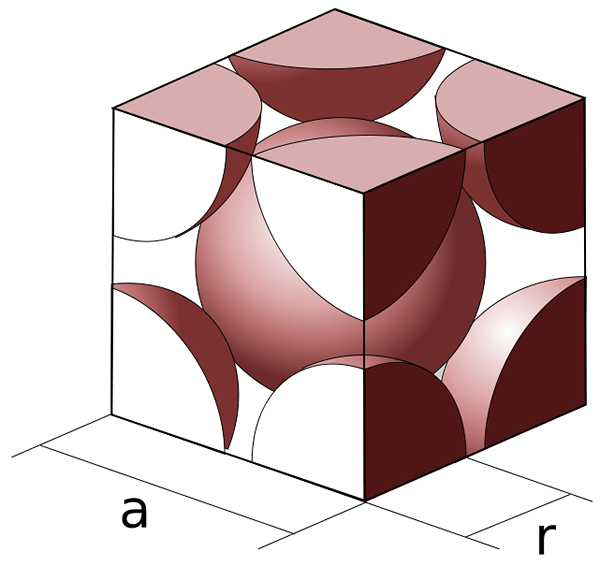
El término BCC significa la disposición cúbica centrada en el cuerpo de las esferas (átomos, moléculas o iones de los que está hecha la red). En esta disposición, las esferas se encuentran en cada esquina de un cubo y una esfera en el medio del cubo. Una celda unitaria de una red es la unidad más pequeña que se asemeja a toda la estructura de la red. Dado que un cubo tiene 8 esquinas, hay un total de 9 esferas en una estructura BCC (ocho en las esquinas más en el medio).
Sin embargo, cada esfera en la esquina de la celda unitaria de BCC es un miembro de la celda unitaria vecina. Esto se debe a que la red está hecha de muchas celdas unitarias empacadas. Dado que hay 8 esferas en una celda unitaria que son las esquinas de otras celdas unitarias, se sabe que el número de coordinación de la estructura BCC es 8. Luego, cuando se considera el total neto de las esferas en una celda unitaria BCC, tiene 2 esferas porque una esquina tiene 1/8th de esferas. Las ocho esquinas juntas forman una esfera, y hay una esfera en el medio, junto con los resultados en dos esferas.

Figura 01: estructura BCC
El embalaje de las esferas en la disposición de BCC no es apretado. Eso significa que el embalaje de esferas en BCC no es un embalaje cercano como en FCC (cúbico centrado en la cara) o HCP (embalaje hexagonal de cierre). El factor de embalaje de BCC es 0.68. El factor de embalaje es el volumen de esferas según el volumen de la celda unitaria. Los ejemplos de metales que tienen la estructura BCC incluyen litio (Li), sodio (NA), potasio (K), cromo (CR) y bario (BA).
¿Qué es la FCC??
El término FCC representa la disposición cúbica centrada en la cara de las esferas. En esta disposición, las esferas se encuentran en cada esquina de un cubo (celda unitaria) y en los centros de cada cara cúbica. Aquí también, cada esfera en las esquinas es miembro de la celda unitaria vecina. Además de eso, cada esfera en el centro de la cara cúbica se comparte con la celda unitaria adyacente.
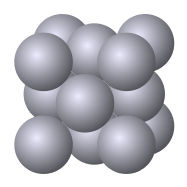
Figura 2: estructura de FCC
El número de coordinación de FCC es de 12. Esto se debe a que hay 12 esferas por celda unitaria que se comparten con otras celdas unitarias. El total neto de las esferas presentes en la celda unitaria de FCC es 4. Se puede calcular de la siguiente manera.
Total esferas en las esquinas = (1/8) x 8 = 1
Total de las esferas en caras cúbicas = (1/2) x 6 = 3
Entonces las esferas totales por celda unitaria = 1 + 3 = 4
La estructura de la FCC tiene más empacación de esferas que la de BCC (las esferas empacan juntas). El factor de embalaje de la estructura FCC es 0.74. Esto significa que la relación entre el volumen ocupado por las esferas y el volumen total de la celda unitaria es 0.74. Algunos ejemplos de metales que tienen estructura FCC son aluminio (Al), cobre (Cu), oro (AU), plomo (PB) y níquel (NI).
¿Cuáles son las similitudes entre BCC y FCC??
- Tanto BCC como FCC son formas de disposición de redes cúbicas.
- La celda unitaria de las estructuras BCC y FCC es un cubo.
¿Cuál es la diferencia entre BCC y FCC??
BCC vs FCC | |
| El término BCC significa la disposición cúbica centrada en el cuerpo de las esferas (átomos, moléculas o iones de los que está hecha la red). | El término FCC representa la disposición cúbica de las esferas centradas en la cara. |
| Disposición de las esferas | |
| BCC tiene esferas en las ocho esquinas de un cubo y una esfera en el centro del cubo. | FCC tiene esferas en las ocho esquinas de un cubo y también en los centros de las caras cúbicas. |
| Número de coordinación | |
| El número de coordinación de la estructura BCC es 8. | El número de coordinación de la estructura FCC es 12. |
| Factor de embalaje | |
| El factor de embalaje de BCC es 0.68 | El factor de embalaje de la FCC es 0.74 |
| Número de esferas en una celda unitaria | |
| Una celda unitaria de BCC tiene un total neto de 2 esferas. | Una celda unitaria de FCC tiene un total neto de 4 esferas. |
| Ejemplos | |
| Algunos ejemplos de metales que tienen la estructura BCC incluyen litio (Li), sodio (NA), potasio (K), cromo (CR) y bario (BA). | Algunos ejemplos de metales que tienen estructura FCC son aluminio (Al), cobre (Cu), oro (AU), plomo (PB) y níquel (NI). |
Resumen - BCC VS FCC
BCC significa la disposición cúbica centrada en el cuerpo. FCC significa la disposición cúbica centrada en la cara. Estas arreglos se utilizan para describir la ubicación de los átomos, moléculas o iones y los espacios vacíos presentes en una estructura de celosía. La diferencia entre BCC y FCC es que el número de coordinación de BCC es 8, mientras que el número de coordinación de FCC es de 12.
Referencia:
1.Estructuras cristalinas metálicas primarias. Disponible aquí
2."FCC y BCC."Bindt. Disponible aquí
Imagen de cortesía:
1.'CCC Crystal Cell (Opque)' por Daniele Pugliesi (CC BY-SA 3.0) a través de Commons Wikimedia
2.'FCC Crystal Structure' By User: Arte - Trabajo propio, (dominio público) a través de Commons Wikimedia


