Diferencia entre ligandos bidentados y ambidiados
Diferencia clave: Bidentate VS Ambidato Ligandos
El diferencia clave entre los ligandos bidentados y ambidiados es que Los ligandos bidentados pueden unirse a un átomo central a través de dos enlaces al mismo tiempo, mientras que los ligandos ambidiados pueden formar dos enlaces con un átomo central, pero formar solo un enlace a la vez.
Los ligandos son moléculas o aniones ricos en electrones que pueden donar pares de electrones solitarios a un átomo que tiene una carga eléctrica positiva. Hay varios tipos de ligandos nombrados como ligandos monodentados, ligandos bidentados, ligandos poldentados, etc. Basado en la cantidad de enlaces que pueden formar con un átomo.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los ligandos bidentados?
3. ¿Qué son los ligandos ambidiados?
4. Similitudes entre ligandos bidentados y ambidatos
5. Comparación de lado a lado: ligandos Bidentate vs Ambidentate en forma tabular
6. Resumen
¿Qué son los ligandos bidentados??
Los ligandos bidentados son moléculas o aniones que pueden unirse a un átomo a través de dos enlaces covalentes de coordenadas. Los enlaces covalentes coordinados son un tipo de enlaces covalentes que se forman cuando una especie química rica en electrones dona pares de electrones solitarios a una especie química deficiente en electrones, como átomos de metal cargados positivamente. Cuando los ligandos y los cationes se unen de esta manera, se forma un compuesto de coordinación. El átomo al que se unen los ligandos se llama centro de coordinación.
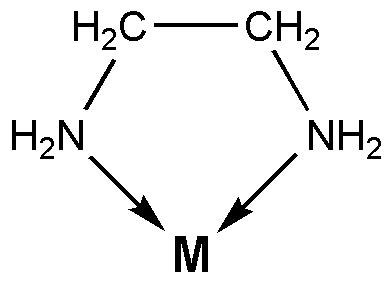
Figura 01: la etilendiamina es un ligando bidentado
Un ligando bidentado tiene dos átomos donantes. Esto significa que hay dos átomos que pueden donar sus pares de electrones solitarios. Algunos ejemplos comunes para los ligandos bidentados incluyen ion oxalato (c2O42-) que tiene dos átomos de oxígeno como átomos donantes y etilendiamina (C₂H₄ (NH₂) ₂) que tiene dos átomos de nitrógeno como átomos de donantes.
¿Qué son los ligandos ambidiados??
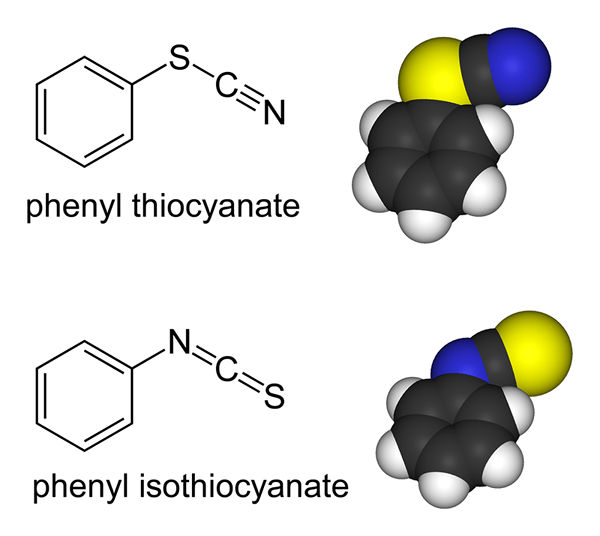
Los ligandos ambidiados son moléculas o iones que tienen dos átomos donantes pero son capaces de unirse con un átomo a través de solo un átomo de donante a la vez. Ejemplos de ligandos ambidiados incluyen ion tiocianato (SCN-) en el que tanto el átomo de azufre como un átomo de nitrógeno son capaces de donar pares de electrones solitarios. Pero el átomo de azufre o el átomo de nitrógeno pueden unirse al centro de coordinación a la vez.

Figura 02: El tiocianato es un ligando ambidiante
Otro ejemplo es el ion nitrato (no2-) en el que tanto el átomo de nitrógeno como el átomo de oxígeno pueden convertirse en un átomo de donantes.
¿Cuáles son las similitudes entre los ligandos bidentados y ambidiados??
- Los ligandos bidentiados y ambidiados tienen dos átomos donantes.
- Ambos ligandos tienen al menos dos átomos con pares de electrones solitarios.
¿Cuál es la diferencia entre los ligandos bidentados y ambidiados??
Ligandos bidentados vs ambidatos | |
| Los ligandos bidentados son moléculas o aniones que pueden unirse a un átomo a través de dos enlaces covalentes de coordenadas. | Los ligandos ambidiados son moléculas o iones que tienen dos átomos donantes pero son capaces de unirse con un átomo a través de solo un átomo de donante a la vez. |
| Formación de bonos | |
| Los ligandos bidentados son capaces de formar dos enlaces coalentes coordinados a la vez. | Los ligandos ambidiados son capaces de formar un enlace coalente coordinado a la vez. |
| Ejemplos | |
| Los ejemplos de ligandos bidentados incluyen etilendiamina e ion oxalato. | Los ejemplos de ligandos ambidiados incluyen iones de tiocianato e ion nitrato. |
Resumen - Bidentate vs Ambidato Ligandos
Los ligandos son moléculas o iones que pueden unirse con átomos deficientes en electrones a través de enlaces covalentes coordinados. Los ligandos bidentados y los ligandos ambidiados son tales dos formas de ligando. La diferencia entre los ligandos bidentados y ambidiados es que los ligandos bidentados pueden unirse con un átomo central a través de dos enlaces al mismo tiempo, mientras que los ligandos ambidiados son capaces de formar dos enlaces con un átomo central pero solo formar un enlace a la vez a la vez.
Referencia:
1. "Ligandos | Tipos de ligandos | Ligando de quelato, denticidad, ligando ambidencial | Química | Byju's."Química, Byjus Classes, 8 Mar. 2018. Disponible aquí
2. Bibliotecas. "Ligandos."Bibliotecas de química, Librettexts, 19 de enero. 2018. Disponible aquí
Imagen de cortesía:
1.'M-en1' por ningún autor legible por máquina proporcionó (dominio público) a través de Commons Wikimedia
2.'PHSCN-PHNCS-Comparison' (dominio público) a través de Commons Wikimedia