Diferencia entre ácidos binarios y oxiácidos

El diferencia clave entre ácidos binarios y oxiácidos es que el Los oxiácidos contienen al menos un átomo de oxígeno en la molécula, pero los ácidos binarios no contienen oxígeno. Los ácidos binarios tienen hidrógeno y otro elemento no metal en la molécula.
Podemos definir un ácido de varias maneras según varios científicos. Según la definición de Arrhenius o Bronsted-Lowry, un compuesto debe tener un átomo de hidrógeno y debe poder donarlo como un protón si lo nombramos como un ácido. Pero según Lewis, hay moléculas, que no poseen hidrógeno, pero pueden actuar como un ácido, yo.mi. BCL3 es un ácido de Lewis, porque puede aceptar un par de electrones. Independientemente de los tipos anteriores, podemos describir y clasificar los ácidos de muchas otras maneras. Por ejemplo, como ácidos inorgánicos y orgánicos dependiendo de los elementos que tienen y también como ácidos y oxiácidos binarios.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los ácidos binarios?
3. ¿Qué son los oxiácidos?
4. Comparación de lado a lado: ácidos binarios frente a oxiácidos en forma tabular
5. Resumen
¿Qué son los ácidos binarios??
Los ácidos binarios son moléculas, que contienen dos elementos; Un elemento es el hidrógeno, y el otro es un elemento no metálico, que es más electronegativo que el hidrógeno. Por lo tanto, los ácidos binarios pueden donar h+ iones en medios acuosos. HCL, HF, HBR y H2S son algunos de los ejemplos de ácidos binarios. Estos muestran diferentes propiedades cuando están en forma pura y cuando están en medios acuosos.
En la nomenclatura de los ácidos binarios, si el ácido está en forma pura, el nombre comienza con "hidrógeno", y el nombre aniónico termina con "-ide". Por ejemplo, podemos nombrar HCl como cloruro de hidrógeno. Los nombres de soluciones de ácido binario acuoso están comenzando con "Hydro", y el nombre de anión termina con "IC". Allí, agregamos la palabra "ácido" al final del nombre. Por ejemplo, la solución acuosa de HCl es el ácido clorhídrico.

Figura 01: HCl es un ácido binario
Además, podemos determinar la fuerza del ácido binario por lo fácil que dona h+ al medio. Si el enlace entre el hidrógeno y el otro elemento es débil, puede donar fácilmente el protón; Por lo tanto, el ácido es más fuerte. La estabilidad del anión formado también está afectando la capacidad de donación de protones. Por ejemplo, hola es un ácido más fuerte que HCL, porque yo- el anión es más estable que el CL- anión.
¿Qué son los oxiácidos??
Los oxiácidos son ácidos que contienen un átomo de oxígeno en la molécula. HNO3, H2ENTONCES4, H2CO3, H3correos4, Pez3COOH son algunos de los oxiácidos comunes. Aparte del oxígeno, hay al menos otro elemento y al menos un átomo de hidrógeno en la molécula.
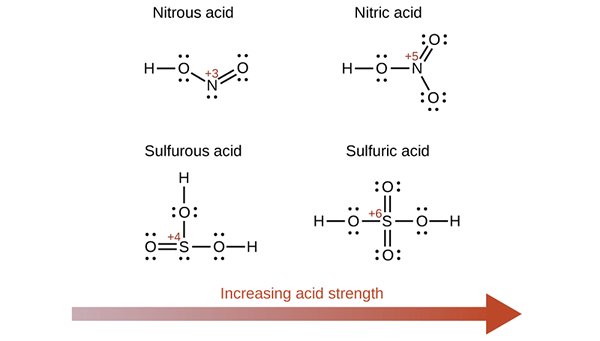
Figura 02: Algunos oxiácidos y su fuerza ácida
La capacidad de donar uno o más protones es esencial para que el elemento sea un ácido. El hidrógeno de la oxiácida se une con el átomo de oxígeno. Por lo tanto, en estos ácidos, podemos determinar la acidez por la electronegatividad del átomo central y el número de átomos de oxígeno.
¿Cuál es la diferencia entre ácidos binarios y oxiácidos??
Los ácidos binarios son moléculas, que contienen dos elementos; Un elemento es el hidrógeno, y el otro es un elemento no metálico. Mientras que los oxyácidos son ácidos que contienen un átomo de oxígeno en la molécula. Por lo tanto, la diferencia clave entre los ácidos binarios y los oxiácidos es que los oxiácidos contienen al menos un átomo de oxígeno en la molécula, pero los ácidos binarios no contienen oxígeno.
Como otra diferencia significativa entre el ácido binario y los oxiácidos, en los oxiácidos, el protón que se está donando se une a los átomos de oxígeno. En los ácidos binarios, los hidrógenos están unidos al otro elemento no metálico.
A continuación se muestra una infografía sobre la diferencia entre el ácido binario y los oxiácidos.

Resumen: ácidos binarios vs oxyácidos
Los ácidos binarios y los oxiácidos son dos tipos de compuestos ácidos. La diferencia clave entre los ácidos binarios y los oxiácidos es que los oxiácidos contienen al menos un átomo de oxígeno en la molécula y los ácidos binarios no contienen oxígeno. Los ácidos binarios tienen hidrógeno y otro elemento no metal en la molécula.
Referencia:
1. Helmenstine, Anne Marie, PH.D. “Definición y ejemplos de oxiácidos."Thinkco, junio. 22, 2018. Disponible aquí
2. Helmenstine, Anne Marie, PH.D. "Definición de ácido binario."Thinkco, junio. 22, 2018. Disponible aquí
Imagen de cortesía:
1."CNX Chem 14 03 Oxyacid" por OpenStax (CC por 4.0) a través de Commons Wikimedia


