Diferencia entre el modelo BOHR y Quantum
Diferencia de clave: Bohr vs Quantum Model
El modelo bohr y el modelo cuántico son modelos que explican la estructura de un átomo. El modelo Bohr también se llama modelo Rutherford-Bohr porque es una modificación del modelo Rutherford. El modelo Bohr fue propuesto por Niels Bohr en 1915. El modelo cuántico es el modelo moderno de un átomo. La diferencia clave entre Bohr y Quantum Model es que El modelo Bohr establece que los electrones se comportan como partículas mientras El modelo cuántico explica que el electrón tiene comportamiento de partículas y olas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el modelo bohr?
3. ¿Qué es el modelo cuántico?
4. Comparación de lado a lado - Bohr vs Quantum Model en forma tabular
5. Resumen
¿Qué es el modelo bohr??
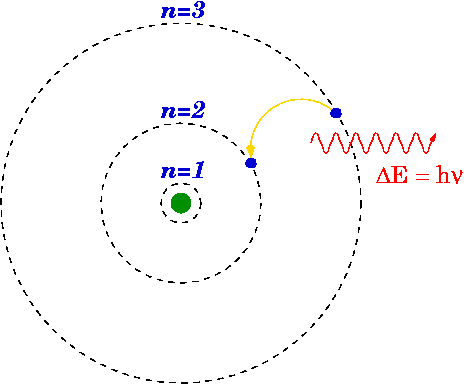
Como se mencionó anteriormente, el modelo Bohr es una modificación del modelo Rutherford ya que el modelo Bohr explica la estructura del átomo como compuesta por un núcleo rodeado de electrones. Pero el modelo Bohr es más avanzado que el modelo Rutherford porque dice que los electrones siempre viajan en capas o órbitas específicas alrededor del núcleo. Esto también establece que estas conchas tienen diferentes energías y son de forma esférica. Que fue sugerido por observaciones de los espectros de línea para el átomo de hidrógeno.
Debido a la presencia de líneas discretas en los espectros de línea, Bohr declaró que los orbitales de un átomo tienen energías fijas y electrones pueden saltar de un nivel de energía a otro emisor o absorción de energía, lo que resulta en una línea en el espectro de línea de línea.
Postulados principales del modelo Bohr
-
Los electrones se mueven alrededor del núcleo en orbitales esféricos que tienen un tamaño y energía fijos.
- Cada órbita tiene un radio diferente y se nombra desde el núcleo hasta el exterior como N = 1, 2, 3, etc. o n = k, l, m, etc. donde n es el número de nivel de energía fijo.
- La energía de un orbital está relacionada con su tamaño.
- La órbita más pequeña tiene la energía más baja. El átomo es completamente estable cuando los electrones están en el nivel de energía más bajo.
- Cuando un electrón se mueve en cierto orbital, la energía de ese electrón es constante.
- Los electrones pueden moverse de un nivel de energía a otro absorbiendo o liberando energía.
-
Este movimiento causa radiación.
El modelo Bohr se ajusta perfectamente al átomo de hidrógeno que tiene un solo electrón y un pequeño núcleo cargado positivamente. Aparte de eso, Bohr usó la constante de la tabla para calcular la energía de los niveles de energía del átomo.

Figura 01: El modelo BOHR para hidrógeno
Pero había pocos inconvenientes del modelo Bohr al explicar la estructura atómica de los átomos que no sean hidrógeno.
Limitaciones del modelo BOHR
- El modelo Bohr no pudo explicar el efecto Zeeman (efecto del campo magnético en el espectro atómico).
- No pudo explicar el efecto marcado (efecto del campo eléctrico en el espectro atómico).
- El modelo Bohr no explica los espectros atómicos de átomos más grandes.
¿Qué es el modelo cuántico??
Aunque el modelo cuántico es mucho más difícil de entender que el modelo BOHR, explica con precisión las observaciones con respecto a los átomos grandes o complejos. Este modelo cuántico se basa en la teoría cuántica. Según la teoría cuántica, un electrón tiene dualidad de onda de partículas y es imposible localizar la posición exacta del electrón (principio de incertidumbre). Por lo tanto, este modelo se basa principalmente en la probabilidad de que un electrón se encuentre en cualquier parte del orbital. También establece que los orbitales no siempre son esféricos. Los orbitales tienen formas particulares para diferentes niveles de energía y son estructuras 3D.
Según el modelo cuántico, se puede dar un nombre a un nombre con el uso de números cuánticos. En esto se utilizan cuatro tipos de números cuánticos;
- Número cuántico principal, n
- Número cuántico de momento angular, yo
- Número cuántico magnético, ml
- Número cuántico de giro, Ms
El Número cuántico principal explica la distancia promedio del orbital desde el núcleo y el nivel de energía. El Número cuántico de momento angular explica la forma del orbital. El número cuántico magnético describe la orientación de los orbitales en el espacio. El Número cuántico de giro Da el giro de un electrón en un campo magnético y las características de onda del electrón.
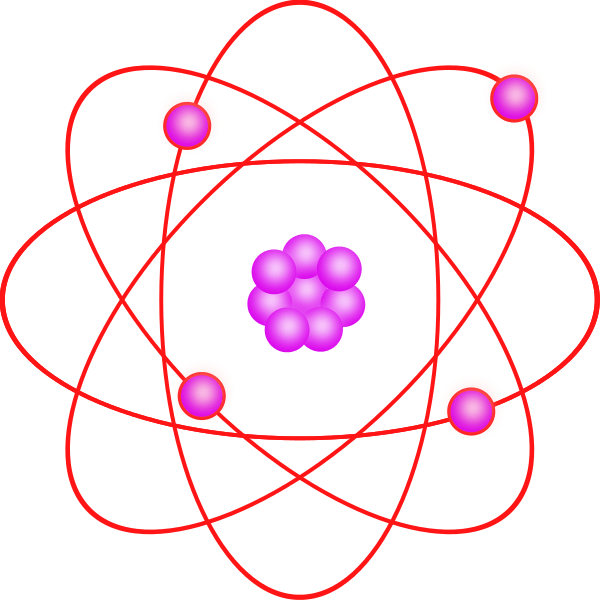
Figura 2: Estructura espacial de los orbitales atómicos.
¿Cuál es la diferencia entre el modelo bohr y cuántico??
BOHR VS MODELO CUESTO | |
| El modelo Bohr es un modelo atómico propuesto por Niels Bohr (en 1915) para explicar la estructura de un átomo. | El modelo cuántico es un modelo atómico que se considera como el modelo atómico moderno para explicar la estructura de un átomo con precisión. |
| Comportamiento de los electrones | |
| El modelo bohr explica el comportamiento de las partículas de un electrón. | El modelo cuántico explica la dualidad de la partícula de onda de un electrón. |
| Aplicaciones | |
| El modelo BOHR se puede aplicar para átomos de hidrógeno pero no para átomos grandes. | El modelo cuántico se puede usar para cualquier átomo, incluidos los más pequeños y átomos grandes y complejos. |
| Forma de orbitales | |
| El modelo Bohr no describe las formas exactas de cada orbital. | El modelo cuántico describe todas las formas posibles que un orbital puede tener. |
| Efectos electromagnéticos | |
| El modelo Bohr no explica el efecto Zeeman (efecto del campo magnético) o el efecto marcado (efecto del campo eléctrico). | Quantum Model explica los efectos de Zeeman y Stark con precisión. |
| Números cuánticos | |
| El modelo Bohr no describe los números cuánticos distintos del número cuántico principal. | El modelo cuántico describe los cuatro números cuánticos y las características de un electrón. |
Resumen - Bohr vs Quantum Model
Aunque los científicos propusieron varios modelos atómicos diferentes, los modelos más notables fueron el modelo Bohr y el modelo cuántico. Estos dos modelos están estrechamente relacionados, pero el modelo cuántico es mucho más detallado que el modelo BOHR. Según el modelo BOHR, un electrón se comporta como una partícula, mientras que el modelo cuántico explica que el electrón tiene comportamiento de partículas y olas. Esta es la principal diferencia entre Bohr y Model Quantum.
Descargar la versión PDF de Bohr vs Quantum Model
Puede descargar la versión PDF de este artículo y usarla para fines fuera de línea según las notas de la cita. Descargue la versión PDF aquí Diferencia entre Bohr y Quantum Model.
Referencias:
1. "Modelo Bohr de un átomo | Teoría atómica de Schrodinger." Química. Clases de Byjus, 08 de noviembre. 2016. Web. Disponible aquí. 05 de junio de 2017.
2. "Estructura atómica: el modelo mecánico cuántico." Tontos. norte.pag., norte.d. Web. Disponible aquí. 05 de junio de 2017.
Imagen de cortesía:
1. "Bohr Model Balmer 32" (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Atom Clipart Violet" (dominio público) a través de Commons Wikimedia


