Diferencia entre el modelo Bohr y Rutherford
Diferencia clave - Bohr vs Rutherford Modelo
El concepto de átomos y su estructura fue introducido por primera vez por John Dolton en 1808. Explicó las leyes de la combinación química al considerar los átomos como partículas invisibles sin estructura. Luego, en 1911, el físico de Nueva Zelanda, Ernest Rutherford, propuso que los átomos consisten en dos componentes: un núcleo cargado positivamente en el centro del átomo y electrones cargados negativamente en la parte extranuclear del átomo. Ciertas teorías, como la teoría electromagnética presentada por Maxwell, no se pueden explicar con el modelo de Rutherford. Debido a tales limitaciones en el modelo de Rutherford, el físico danés Niels Bohr propuso un nuevo modelo en 1913 basado en la teoría cuántica de las radiaciones. El modelo de Bohr fue en gran medida aceptado y recibió el Premio Nobel por su trabajo. Aunque fue aceptado en gran medida, todavía tiene ciertos inconvenientes y limitaciones. La principal diferencia entre el modelo bohr y el modelo de rutherford es que En el modelo de Rutherford, los electrones pueden girar en cualquier órbita alrededor del núcleo, mientras que en el modelo Bohr, los electrones pueden girar en una cubierta definida.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el modelo bohr?
3. ¿Qué es el modelo de Rutherford?
4. Comparación de lado a lado - Bohr vs Rutherford Modelo en forma tabular
6. Resumen
¿Qué es el modelo bohr??
El modelo de Bohr fue propuesto por Niels Bohr en 1922 para explicar la estructura del átomo. En este modelo, Bohr mencionó que la mayor parte de la masa atómica se encuentra en el núcleo central que contiene protones y electrones se organizan en niveles de energía definidos y giran alrededor del núcleo. El modelo también propuso la configuración electrónica, que explica la disposición de electrones en órbitas circulares designadas como K, L, M, N, etc. Los átomos con configuraciones de electrones completas no están activas. La configuración de los electrónicos determina la reactividad del átomo.

Figura 01: Modelo Bohr
El modelo de Bohr es capaz de explicar el espectro del átomo de hidrógeno, pero no puede explicar completamente la reactividad de los átomos multielectrones. Además, no explica el efecto Zeeman, donde cada línea espectral se divide en más líneas en presencia de un campo magnético externo. En este modelo, un electrón se considera solo como una partícula. Sin embargo, un físico francés, De Broglie, descubrió que los electrones tienen propiedades de ondas y partículas. Más tarde, un físico presentó otro principio llamado Principio de incertidumbre de Heisenberg, que explica la imposibilidad de la determinación simultánea de la posición exacta y el impulso de pequeñas partículas en movimiento como los electrones. Con este invento, el modelo de Bohr se enfrentó a un revés serio.
¿Qué es el modelo de Rutherford??
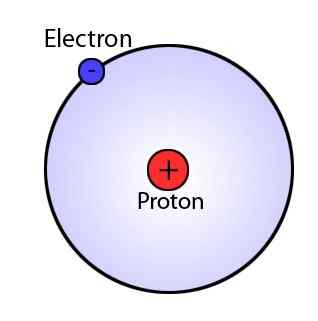
En 1911, Ernest Rutherford propuso el modelo de Rutherford. Establece que el átomo (el volumen) consiste principalmente en el espacio y la masa del átomo se centra en el núcleo, que es el núcleo del átomo. El núcleo se carga positivamente y la órbita de electrones alrededor del núcleo. Las órbitas no tienen caminos definidos. Además, dado que los átomos son neutros, tienen cargas (electrones) positivas (en el núcleo) y negativas.

Figura 02: Rutherford Atom
El modelo de Rutherford no pudo explicar la teoría electromagnética, la estabilidad del átomo y la existencia de líneas definidas en el espectro de hidrógeno.
¿Cuál es la diferencia entre Bohr y Rutherford Model??
Bohr vs Rutherford Modelo | |
| El modelo Bohr fue propuesto por Niels Bohr en 1922. | El modelo de Rutherford fue propuesto por Ernest Rutherford en 1911. |
| Teoría | |
| La mayor parte de la masa atómica se encuentra en el núcleo central, que contiene protones, y los electrones están dispuestos en niveles de energía o conchas definitivas. | La mayoría del átomo consiste en espacio vacío. El centro del átomo contiene un núcleo cargado positivamente y sus electrones cargados negativamente están presentes en el espacio que rodea el núcleo. |
| Emisión de radiación de electrones | |
| Los electrones solo emiten ondas de frecuencias definidas. | Los electrones emiten ondas de todas las frecuencias. |
| Espectro de emisión de electrones | |
| El espectro de emisión de electrones es un espectro de línea. | El espectro de emisión de electrones es un espectro continuo. |
Resumen -Bohr vs Rutherford Model
Tanto los modelos Bohr como Rutherford son modelos planetarios que explican la estructura atómica hasta cierto punto. Estos modelos tienen limitaciones y no explican algunos principios modernos de la física. Sin embargo, estos modelos contribuyen en gran medida a modelos avanzados modernos que explican la estructura atómica. El modelo BOHR establece que la mayor parte de la masa atómica está en el núcleo central, que contiene protones y que los electrones están dispuestos en niveles o capas de energía definidas, lo que resulta en el espectro de la línea de electrones. El modelo de Rutherford establece que la mayoría del átomo consiste en un espacio vacío y el centro del átomo contiene un núcleo cargado positivamente rodeado por electrones cargados negativamente, lo que resulta en un espectro de electrones continuo. Esta es la diferencia entre Bohr y Rutherford Model.
Descargar la versión PDF de Bohr vs Rutherford Model
Puede descargar la versión PDF de este artículo y usarla para fines fuera de línea según las notas de la cita. Descargue la versión PDF aquí Diferencia entre Bohr y Rutherford Model.
Referencias:
1. Tarendash, un. S. Revisemos: Química, el entorno físico. Serie Educativa de Barron, 2006. Imprimir.
2. Warren, D. Químicos en un contexto social e histórico: los químicos son personas reales, que viven en el mundo real. Royal Society of Chemistry, 2001. Imprimir.
Imagen de cortesía:
1. "Modelo Bohr" de JIA.Liu - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Rutherford Atom" por propio trabajo (CrearJoder XD XD) (CC BY-SA 3.0) a través de Commons Wikimedia


