Diferencia entre el dipolo de enlace y el dipolo molecular
El Diferencia clave Bentre el dipolo de enlace y el dipolo molecular es que Dipolo de enlace se refiere a la creación de dos extremos polares en un enlace químico particular. Mientras que el dipolo molecular se refiere a la creación de dos extremos polares en un compuesto químico particular.
Los términos enlaces dipolo y dipolo molecular son importantes para determinar las propiedades químicas y físicas de un compuesto químico. Un dipolo es el estado de tener dos extremos con una polaridad diferente existente en el mismo enlace químico o compuesto químico.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un dipolo de enlace?
3. ¿Qué es un dipolo molecular?
4. Comparación lado a lado - Dipolo de enlace vs dipolo molecular en forma tabular
5. Resumen
¿Qué es un dipolo de enlace??
Un dipolo de enlace es la presencia de dos extremos cargados opuestos en el mismo enlace químico. Un momento dipolar de enlace es un momento dipolo eléctrico donde hay una carga positiva y una carga negativa en el mismo enlace químico. Esta separación de carga ocurre debido a la polaridad del enlace químico. Podemos denotar dipolo de enlace como "". Podemos dar el dipolo de enlace en función de la carga eléctrica parcial del enlace que está dada por "δ", y la distancia entre los extremos cargados dados por "D" como sigue:
= ΔD
Un dipolo de enlace es un vector que es paralelo al eje de enlace y sus puntos de menos (carga negativa) a Plus (carga positiva). Sin embargo, en química, generalmente dibujamos este vector apuntando de ventaja a menos, para indicar el movimiento físico de los electrones.
La unidad SI para la medición de un dipolo de enlace es el medidor de coulomb. Prácticamente, esta unidad no es adecuada porque ofrece valores demasiado grandes. Por lo tanto, podemos usar la unidad Debye con el símbolo "D" que usa la carga en (10-10 x) statcuolombs y distancia en angstroms.

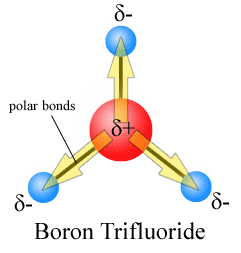
Figura 01: indicando los dipolos de enlace en una molécula con tres enlaces químicos
Para las moléculas poliatómicas, el dipolo de enlace es una característica de un enlace químico particular dentro de la molécula. Para las moléculas diatómicas, solo hay un enlace entre dos átomos; Por lo tanto, el dipolo de enlace y el dipolo molecular son los mismos.
¿Qué es el dipolo molecular??
Dipolo molecular es la presencia de dos extremos cargados opuestos en la misma molécula. Este tipo de momento dipolar surge debido a la polaridad neta de la molécula. La polaridad neta o la polaridad general de una molécula viene con el efecto de la forma de la molécula y la polaridad de cada enlace químico.
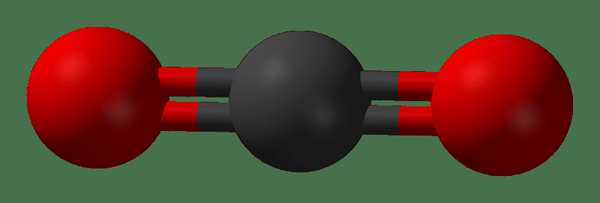
Figura 02: Estructura de la molécula de dióxido de carbono
A veces, una molécula que tiene enlaces químicos polar puede no tener una polaridad neta debido a la forma que equilibra la polaridad neta para ser cero. Por ejemplo, una molécula lineal con dos enlaces polares. Aquí, los vectores de momento dipolo de los dos enlaces se cancelan. mi.gramo. dióxido de carbono.
¿Cuál es la diferencia entre el dipolo de enlace y el dipolo molecular??
La diferencia clave entre el dipolo de enlace y el dipolo molecular es que el término dipolo de enlace se refiere a la creación de dos extremos polares en un enlace químico particular, mientras que el término dipolo molecular se refiere a la creación de dos extremos polares en un compuesto químico particular. En otras palabras, se administra un dipolo de enlace para un enlace particular dentro de una molécula, mientras que se da dipolo molecular para un compuesto químico particular.
Debajo de la infografía resume la diferencia entre el dipolo de enlace y el dipolo molecular.
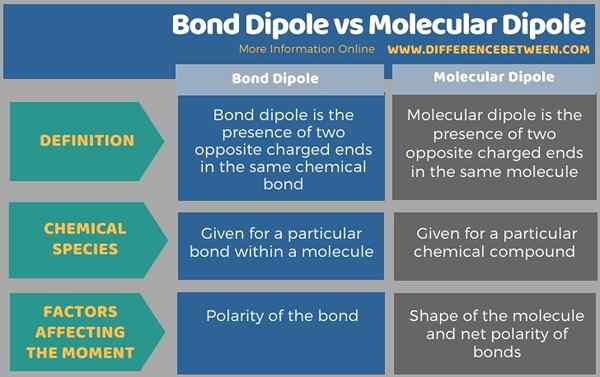
Resumen -Dipolo de enlace vs dipolo molecular
Dipolo y dipolo molecular de enlace son dos términos que son importantes en la determinación de las propiedades químicas y físicas de las especies químicas. La diferencia clave entre el dipolo de enlace y el dipolo molecular es que el término dipolo de enlace se refiere a la creación de dos extremos polares en un enlace químico particular, mientras que el término dipolo molecular se refiere a la creación de dos extremos polares en un compuesto químico particular.
Referencia:
1. "Momentos dipolares."Bibliotecas de química, Librettexts, 30 de septiembre. 2019, disponible aquí.
2. "Bond Moment Dipole."Wikipedia, Fundación Wikimedia, 17 de diciembre. 2019, disponible aquí.
Imagen de cortesía:
1. "Polarity Boron Trifluoride" de Emma Farmer (Serephine en English Wikipedia) - creado con Adobe Photoshop (dominio público) a través de Commons Wikimedia
2. "Balls de dióxido de carbono-3D" de Benjah-BMM27-Trabajo propio (dominio público) a través de Commons Wikimedia


