Diferencia entre la energía de enlace y la energía de disociación de enlaces
El diferencia clave entre la energía de enlace y la energía de disociación de enlaces es que el La energía del enlace es un valor promedio, mientras que la energía de disociación del enlace es un valor particular para un enlace particular.
Según lo propuesto por el químico estadounidense g.norte.Lewis, los átomos son estables cuando contienen ocho electrones en su carcasa de valencia. La mayoría de los átomos tienen menos de ocho electrones en sus conchas de valencia (excepto los gases nobles en el grupo 18 de la tabla periódica); Por lo tanto, no son estables. Por lo tanto, estos átomos tienden a reaccionar entre sí, a ser estables. Puede ocurrir formando enlaces iónicos, enlaces covalentes o enlaces metálicos dependiendo de la electronegatividad de los átomos. Cuando dos átomos tienen una diferencia de electronegatividad similar o muy baja, reaccionan juntos, forman un enlace covalente compartiendo electrones. Energía de enlace y energía de disociación de enlaces son dos conceptos con respecto a los enlaces químicos covalentes.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la energía de enlace?
3. ¿Qué es la energía de disociación de enlaces?
4. Comparación de lado a lado - Energía de enlace versus energía de disociación de enlace en forma tabular
5. Resumen
¿Qué es la energía de enlace??
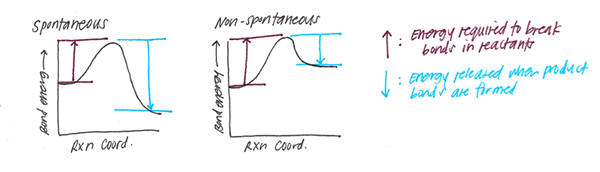
Cuando se forman los enlaces, se libera cierta cantidad de energía. En contraste, la ruptura de los enlaces requiere cierta cantidad de energía. Para un cierto enlace químico, esta energía es constante. Y lo nombramos como la energía de enlace. Por lo tanto, la energía de enlace es la cantidad de calor requerida para romper un mol de moléculas en sus átomos correspondientes.
Además, podemos observar la energía de un enlace químico en varias formas como energía química, energía mecánica o energía eléctrica. Sin embargo, en última instancia, todas estas energías se convierten en calor. Por lo tanto, podemos medir la energía de enlace en Kilojoule o Kilocalorie.

Figura 01: energía de enlace
Además, la energía de enlace es un indicador de la fuerza de enlace. Por ejemplo, los enlaces más fuertes son difíciles de escindir. Por lo tanto, las energías de enlace de ellos son más grandes. Por otro lado, los enlaces débiles tienen pequeñas energías de enlace, y son fáciles de escindir. La energía de enlace también indica la distancia de enlace. Las energías de enlace más altas significan que la distancia de enlace es baja (por lo tanto, la resistencia de la unión es alta). Además, cuando la energía de enlace es baja, la distancia de unión es mayor. Como se menciona en la introducción, la electronegatividad juega un papel en la formación de enlaces. Por lo tanto, la electronegatividad de los átomos también contribuye a la energía de enlace.
¿Qué es la energía de disociación de enlaces??
La energía de disociación de enlaces también es una medición de la resistencia al enlace. Podemos definirlo como el cambio de entalpía que tiene lugar cuando un vínculo se somete a escisión por homólisis. La energía de disociación de enlaces es específica de un solo enlace.
En este caso, el mismo enlace puede tener diferentes energías de disociación de enlaces dependiendo de la situación. Por ejemplo, hay cuatro enlaces C-H en una molécula de metano, y todos los enlaces C-H no tienen la misma energía de disociación de enlaces.

Figura 02: Algunas energías de disociación de enlaces para complejos de coordinación
Por lo tanto, en la molécula de metano, las energías de disociación de enlaces para enlaces C-H son 439 kJ/mol, 460 kJ/mol, 423 kJ/mol y 339 kJ/mol. Se debe a que la primera rotación de enlace forma una especie radical a través de la homólisis, por lo tanto, la rotura del segundo enlace ocurre de una especie radical, lo que requiere más energía que la primera. Del mismo modo, paso a paso el cambio de las energías de disociación del enlace.
¿Cuál es la diferencia entre la energía de enlace y la energía de disociación de enlaces??
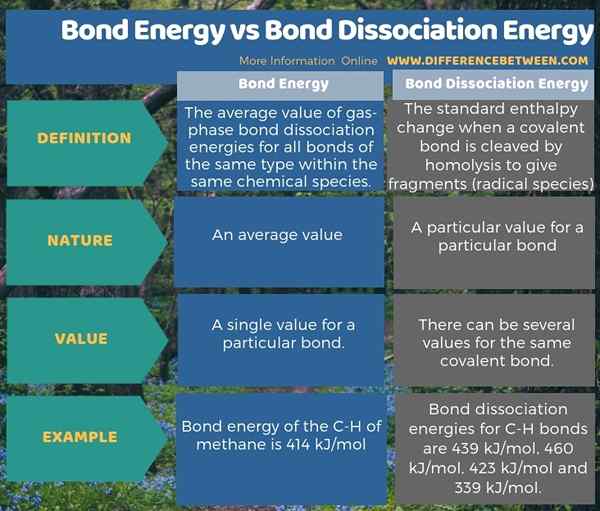
La energía de enlace es el valor promedio de las energías de disociación de enlaces en fase gaseosa (generalmente a una temperatura de 298 K) para todos los enlaces del mismo tipo dentro de las mismas especies químicas. Sin embargo, la energía de enlace y la energía de disociación de enlaces no son la misma. La energía de disociación del enlace es el cambio de entalpía estándar cuando un enlace covalente se escinde por la homólisis para dar fragmentos; que suelen ser especies radicales. Por lo tanto, la diferencia clave entre la energía del enlace y la energía de disociación de enlaces es que la energía de enlace es un valor promedio, mientras que la energía de disociación de enlaces es un valor particular para un enlace particular.
Por ejemplo, en la molécula de metano, las energías de disociación de enlaces para enlaces C-H son 439 kJ/mol, 460 kJ/mol, 423 kJ/mol y 339 kJ/mol. Sin embargo, la energía de enlace del C-H del metano es 414 kJ/mol, que es el promedio de los cuatro valores. Además, para una molécula, la energía de disociación de enlaces puede no ser necesariamente igual a la energía de enlace (como para el ejemplo de metano anterior). Para una molécula diatómica, la energía de enlace y la energía de disociación de enlaces son la misma.
Por debajo de la infografía sobre la diferencia entre la energía de la energía de enlace y la disociación de enlaces proporciona más detalles sobre las diferencias.
Resumen -Energía de enlace vs Energía de disociación de enlaces
La energía de disociación de enlaces es diferente de la energía de enlace. La energía de enlace es el valor promedio de todas las energías de disociación de enlaces de una molécula. Por lo tanto, la diferencia clave entre la energía del enlace y la energía de disociación del enlace es que la energía de enlace es un valor promedio, mientras que la energía de disociación de enlaces es un valor particular para un enlace particular.
Referencia:
1. "Energía de disociación de enlaces."Wikipedia, Fundación Wikimedia, 5 de enero. 2019. Disponible aquí
2. Bibliotecas. "Energías de bonos."Bibliotecas de química, National Science Foundation, 26 de noviembre. 2018. Disponible aquí
Imagen de cortesía:
1."Diagramas de energía de bonos" por Fbarreyro - trabajo propio, (dominio público) a través de Commons Wikimedia
2."Energías de bonos" por Chem540F09Grp8 - Trabajo propio, (dominio público) a través de Commons Wikimedia


