Diferencia entre la energía de enlace y la entalpía de los bonos
Diferencia clave: Energía de Bond Vs Bond Entalpy
Tanto la energía de enlace como la entalpía de enlaces describen el mismo concepto químico; la cantidad de energía requerida para separar un mol de moléculas en sus átomos de componentes. Esto mide la fuerza de un enlace químico. Por lo tanto, también se llama fuerza de enlace. La energía de enlace se calcula como un valor promedio de las energías de disociación de enlaces a 298 K para especies químicas en la fase gaseosa. No hay una diferencia considerable entre los términos energía de enlace y entalpía de bonos, pero La energía de los enlaces se denota por "E", mientras que la entalpía de Bond se denota por "H".
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la energía de enlace?
3. ¿Qué es la entalpía de Bond?
4. Comparación de lado a lado: entalpía de energía vs enlace en forma tabular
5. Resumen
¿Qué es la energía de enlace??
La entalpía de energía o enlace de enlace es una medida de la fuerza de enlace. La energía de enlace es la cantidad de energía requerida para separar un lunar de moléculas en sus átomos de componentes. Esto significa que la energía de enlace es la energía requerida para romper un enlace químico. La energía de enlace se denota como "E". La unidad de medición es kj/mol.
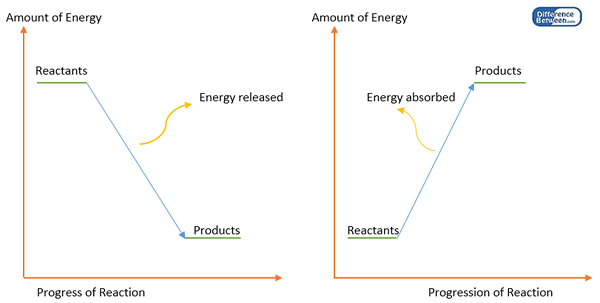
Los enlaces químicos se forman entre los átomos para obtener un estado estable cuando los átomos individuales tienen alta energía que es inestable. Esto significa que la formación de enlaces químicos disminuye la energía de un sistema. Por lo tanto, parte de la energía se libera (generalmente como calor) al formar enlaces químicos. Por lo tanto, la formación de enlaces es una reacción exotérmica. Para romper este enlace químico, se debe proporcionar energía (una cantidad igual de energía a la de la energía liberada mientras se forma el enlace). Esta cantidad de energía se conoce como la entalpía de energía o enlace de enlace.

Figura 1: Diagrama de energía para la formación de enlaces (izquierda) y disociación de enlaces (derecha).
La energía de enlace es igual a la diferencia entre la entalpía de los productos (átomos) y los reactivos (molécula inicial). Cada molécula debe tener sus propios valores de energía de enlace. Pero hay excepciones. Por ejemplo, la energía de enlace del enlace C-H depende de la molécula donde ocurra el enlace. Por lo tanto, la energía de enlace se calcula como un valor promedio de las energías de disociación del enlace.
La energía de enlace es la disociación promedio de la disociación para la misma especie en la fase gaseosa (a 298 k temperatura). Por ejemplo, la energía de enlace de la molécula de metano (CH4) es la cantidad de energía requerida para formar un átomo de carbono y 4 radicales de hidrógeno. Luego, la energía de enlace del enlace C-H se puede calcular tomando la suma de las energías de disociación de enlaces de cada enlace C-H y dividiendo el valor total en 4.
Ej: Energía de enlace del enlace O-H en H2O La molécula se puede calcular de la siguiente manera.
Cantidad de energía requerida para romper el enlace H-OH = 498.7 kJ/mol
La cantidad de energía requerida para romper el enlace O-H (en el Radical OH restante) = 428 kJ/mol
La energía de disociación de enlace promedio = (498.7 + 428) / 2
= 463.35 kJ/mol ≈ 464 kJ/mol
Por lo tanto, la energía de enlace de O-H en H2O La molécula se considera 464 kJ/mol.
¿Qué es la entalpía de Bond??
La entalpía de enlace o la energía de enlace es la cantidad de energía requerida para separar una molécula en sus componentes atómicos. Es una medida de la fuerza de enlace. La entalpía de los bonos se denota como "H".
¿Cuál es la diferencia entre la energía de la unión y la entalpía de los enlaces??
- La entalpía de energía o enlace de enlace es la cantidad de energía requerida para separar un moléculas en sus átomos de componentes.
- La energía de los bonos se denota como "E", mientras que la entalpía de Bond se denota como "H".
Resumen -Energía de Bond Vs Bond Entalpy
La entalpía de energía o enlace de enlace es la cantidad de energía requerida para separar un mol de moléculas en sus componentes atómicos en fase gaseosa. Se calcula utilizando los valores de energía de disociación de enlaces de los enlaces químicos. Por lo tanto, la energía de enlace es el valor promedio de las energías de disociación de enlaces. Siempre es un valor positivo porque la disociación de enlaces es endotérmica (la formación de enlaces es exotérmica). No hay una diferencia considerable entre la energía de enlace y la entalpía de los bonos.
Referencia:
1. "Energías de bonos."Bibliotecas de química, Librettexts, 20 de enero. 2017, disponible aquí.
2. Helmenstine, Anne Marie. "¿Qué es la energía de enlace?"Thinkco, disponible aquí.
3. "Energía de enlace."Wikipedia, Fundación Wikimedia, 13 mar. 2018, disponible aquí.


