Diferencia entre la entalpía de los bonos y la entalpía de la red
El diferencia clave Entre la entalpía de los bonos y la entalpía de la red es que La entalpía del enlace es la cantidad de energía que se requiere para descomponer un enlace químico, mientras que la energía de la red es la cantidad de energía que se requiere para formar un topo de un compuesto iónico de los cationes y aniones en el estado gaseoso.
Ambos términos describen el intercambio de energía entre un sistema y sus alrededores. La entalpía de Bond es lo opuesto a la enoquilla. La entalpía de Bond explica la ruptura de los bonos, mientras que la entalpía de la red explica la formación de bonos. Es por eso que son fenómenos opuestos entre sí.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la entalpía de Bond?
3. ¿Qué es la entalpía de la red?
4. Comparación de lado a lado - Entalpía de Bond Vs Entalpía de red en forma tabular
5. Resumen
¿Qué es la entalpía de Bond??
La entalpía del enlace es la cantidad de energía que se requiere para descomponer un enlace químico. Si aplicamos la definición estándar aquí, dice que la entalpía de los bonos es el cambio de entalpía cuando un mol de enlaces se rompe en una sustancia a 298 k. Dado que este término trata con la ruptura de los bonos, también podemos nombrarlo como energía de disociación de enlaces. Otros sinónimos incluyen fuerza de enlace y energía promedio de enlace.

Figura 01: Energías de enlaces de algunos enlaces químicos
Si el valor de la entalpía de los bonos es alto, significa que el vínculo es muy fuerte y difícil de descomponer. Por lo tanto, requiere más energía para descomponer ese vínculo en particular. Típicamente, las unidades que usamos para la determinación del valor para la entalpía de enlace es Kcal/Mol (kilocalorías por lunar) o kj/mol (kilojulios por lunar).
¿Qué es la entalpía de la red??
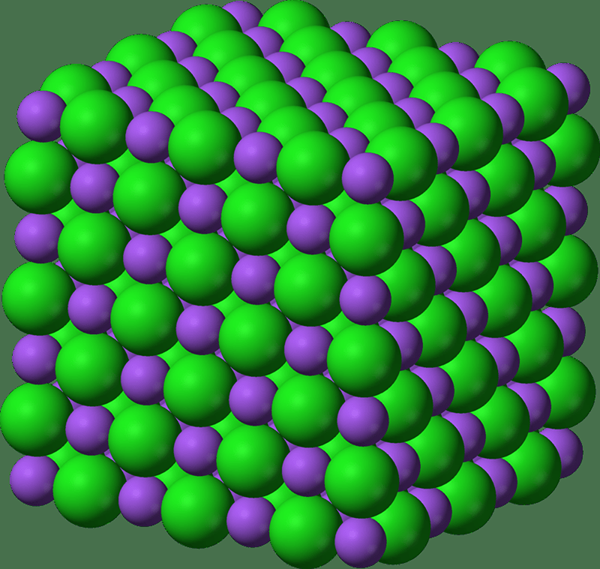
La entalpía de la red es la cantidad de energía que se requiere para formar un lunar de un compuesto iónico en condiciones estándar utilizando los cationes y aniones en el estado gaseoso. Dado que estamos tratando con redes de cristal aquí, el término entalpía de celosía se usa para redes de cristal; En otras palabras, se aplica para compuestos sólidos. Es una medida de las fuerzas que unen los iones (las fuerzas cohesivas).

Figura 02: una estructura de celosía
En general, la energía de la red es importante en la determinación de algunas propiedades físicas, incluida la solubilidad de cristales, dureza y volatilidad. Por lo general, la energía de la red es una energía negativa, pero la entalpía de la red es un valor positivo. Esto se debe a que el volumen de un lunar del sólido cristalino disminuye al formar la red.
¿Cuál es la diferencia entre la entalpía de los bonos y la engalía de la red??
La entalpía de Bond es el proceso opuesto a la entalpía de la red ya que Bond Entalpy trata sobre la ruptura de los bonos, mientras que la entalpía de la red se ocupa de la formación de bonos. Por lo tanto, la diferencia clave entre la entalpía de los enlaces y la entalpía de la red es que la entalpía de los enlaces es la cantidad de energía que se requiere para descomponer un enlace químico, mientras que la energía de la red es la cantidad de energía que se requiere para formar un lunar de un compuesto iónico del cationes y aniones en el estado gaseoso. La entalpía de los bonos es el cambio de entalpía cuando un lunar de enlaces se rompe en una sustancia a 298 k. Por lo tanto, podemos llamarlo como entalpía de disociación de bonos también.
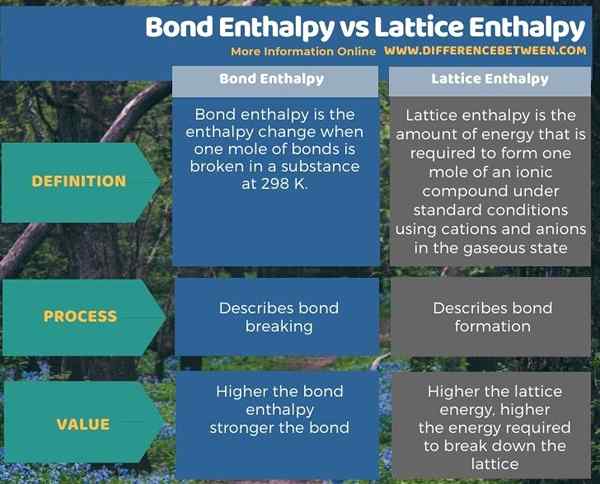
Resumen -Entalpía de Bond Vs Entalpía de celosía
La entalpía de los bonos se ocupa de la ruptura de los bonos, mientras que la entalpía de la red se ocupa de la formación de bonos. Por lo tanto, la diferencia clave entre la entalpía de los enlaces y la entalpía de la red es que la entalpía de los enlaces es la cantidad de energía que se requiere para descomponer un enlace químico, mientras que la energía de la red es la cantidad de energía que se requiere para formar un lunar de un compuesto iónico del cationes y aniones en el estado gaseoso.
Referencia:
1. Helmenstine, Anne Marie. “Definición de entalpía de bonos en química."Thinkco, agosto. 8, 2019, disponible aquí.
2. "Energía de enlace."Wikipedia, Fundación Wikimedia, 4 de noviembre. 2019, disponible aquí.
3. "Energía reticular."Wikipedia, Fundación Wikimedia, 11 de noviembre. 2019, disponible aquí.
Imagen de cortesía:
1. "Energías de bonos" por Chem540F09Grp8 - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Sodium-cloruro-3D-ionic" por Benjah-BMM27 (Talk · Contribs)-Trabajo propio (dominio público) a través de Commons Wikimedia


