Diferencia entre los orbitales moleculares de enlace y antibondación
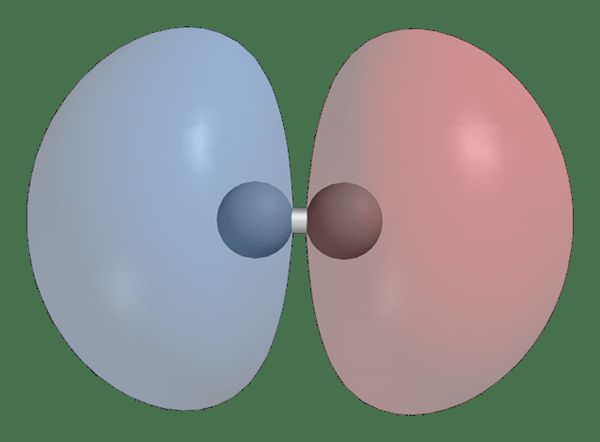
Enlace vs orbitales moleculares de antibondación
La diferencia entre los orbitales moleculares de enlace y antibondación se puede explicar mejor utilizando "Teoría del orbital molecular."Estos dos tipos de orbitales moleculares se forman cuando se forman enlaces químicos covalentes. La diferencia más significativa entre los orbitales moleculares de la unión y la antibondación son sus niveles de energía en comparación con los orbitales atómicos parentales. Esta diferencia de nivel de energía conduce a otras diferencias entre dos orbitales moleculares.
Los orbitales moleculares de enlace y antibondación se forman por orbitales atómicos combinados lineales. Los siguientes conceptos clave son muy importantes, para comprender la diferencia entre los orbitales moleculares de la unión y la antibondación.
Principio de Aufbau - Los orbitales con la energía más baja se llenan primero.
principio de exclusión de Pauli - El número máximo de electrones (con giros opuestos) que pueden ocupar un orbital es dos.
Regla de Hund - Cuando hay varios orbitales moleculares con igual energía, los electrones ocupan los orbitales moleculares uno en un momento antes de que dos ocupan el mismo orbital molecular.
¿Qué son los orbitales moleculares de unión??
Se forman orbitales moleculares de unión de orbitales atómicos por en fase Combinación de orbitales atómicos. Aumenta la densidad de electrones entre los átomos unidos. Su energía es más baja que las orbitales atómicas. Los electrones se llenan primero a los orbitales moleculares de enlace y estabilizan la molécula, ya que asocian menos energía que el electrón en el átomo principal.
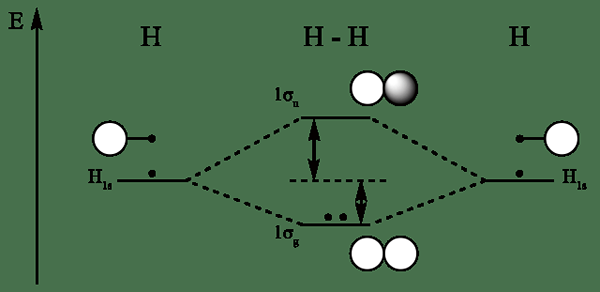
Diagrama orbital molecular para hidrógeno
¿Qué son los orbitales moleculares antibonding??
Los orbitales moleculares de antibonding son formado por fuera de fase Combinación de orbitales atómicos y disminuye la densidad electrónica entre dos átomos. En los orbitales moleculares de antibondación, la energía es más alta que los orbitales atómicos que los formaron. Debido a este hecho, cuando los electrones se llenan en orbitales moleculares de antibonding, desestabiliza el enlace entre dos átomos.

H2 1Sσ* Antibonding Molecular Orbital
¿Cuál es la diferencia entre los orbitales moleculares de unión y los orbitales moleculares de antibondación??
• Energía:
ENERGÍAAntibonding Molecular Orbitals > EnergíaEnlace orbitales moleculares
• La unión de los orbitales moleculares tiene menor energía en comparación con el orbital atómico principal.
• Los orbitales moleculares de antibonding poseen alta energía que la de los orbitales atómicos parentales.
• En general, los electrones se llenan primero en niveles de energía más bajos. Por lo tanto, los electrones se llenan primero a los orbitales moleculares de unión y luego a los orbitales moleculares de antibondación.
• Estabilidad:
• La unión de los orbitales moleculares es más estable que los orbitales moleculares de antibonding y el orbital atómico principal.
• Los orbitales moleculares de antibonding son menos estables que los orbitales moleculares de unión y las orbtiales atómicas parentales.
• La razón principal de la diferencia en la estabilidad es la diferencia de nivel de energía. Cuanto mayor es la energía es la estabilidad. Más bajo la energía es más la estabilidad.
• Disponibilidad de electrones:
• La probabilidad de encontrar un electrón es muy alta en la unión de orbitales moleculares.
• Encontrar un electrón en los orbitales moleculares de antibonding es mínimo.
• Contribución para la forma de la molécula:
• La unión de orbitales moleculares contribuye directamente a la forma de la molécula.
• Los orbitales moleculares de antibondación no contribuyen a la forma de la molécula.
Imágenes Cortesía:
- MO Diagrama Hidrógeno por CCOIL (CC BY-SA 3.0)
- H2 1Sσ* Antibonding Molecular Orbital a través de wikicommons (dominio público)


