Diferencia entre bromo y bromuro

El diferencia clave entre el bromo y el bromuro es que El bromuro es la forma reducida de bromo.
Los elementos químicos en la tabla periódica no son estables, excepto los gases nobles. Por lo tanto, los elementos intentan reaccionar con otros elementos para obtener la configuración de electrones de gas noble para lograr la estabilidad. Del mismo modo, Bromine también tiene que obtener un electrón para lograr la configuración de electrones del Noble Gas Krypton. Todos los metales reaccionan con bromo, formando bromuros. El bromo y el bromuro tienen diferentes propiedades físicas y químicas debido al cambio de un electrón.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es bromo
3. Que es el bromuro
4. Comparación de lado a lado: bromo vs bromuro en forma tabular
5. Resumen
Que es bromo?
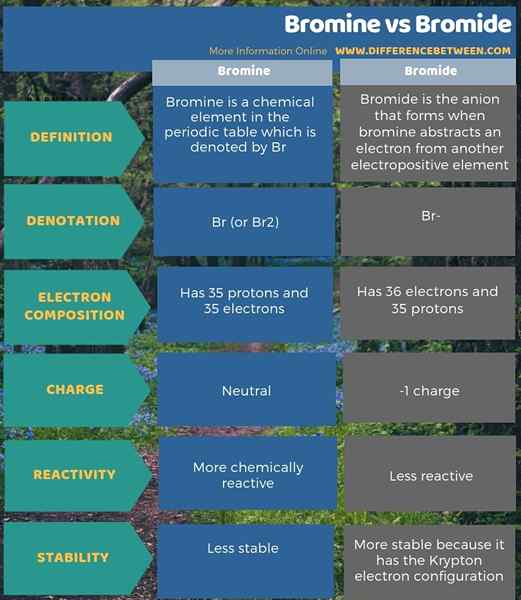
El bromo es un elemento químico en la tabla periódica que se denota por BR. Es un halógeno (17th grupo) en el 4th Período de la tabla periódica. El número atómico de bromo es 35; Por lo tanto, tiene 35 protones y 35 electrones. Su configuración de electrones es [ar] 4s2 3D10 4p5. Desde el pag Subblevel debe tener 6 electrones para obtener la configuración de electrones de gas noble de Krypton, el bromo tiene la capacidad de atraer un electrón. Tiene una alta electronegatividad, que es aproximadamente 2.96, según la escala Pauling.
El peso atómico del bromo es 79.904 amu. Bajo temperatura ambiente, existe como una molécula diatómica (BR2). Además, esta molécula diatómica es un líquido de color marrón rojo. Bromo tiene un punto de fusión de 265.8 K y un punto de ebullición de 332.0 K.
Otras propiedades del bromo
Entre todos los isótopos de bromo, BR-79 y BR-81 son los isótopos más estables. Además, este elemento químico es ligeramente soluble en agua pero bien soluble en solventes orgánicos como el cloroformo. Además, tiene 7, 5, 4, 3, 1, -1 estados de oxidación.
La reactividad química del bromo se encuentra entre la del cloro y el yodo. El bromo es menos reactivo que el cloro pero más reactivo que el yodo. El bromo produce el ion bromuro tomando un electrón. Por lo tanto, el bromo participa fácilmente en la formación de compuestos iónicos. En realidad, en la naturaleza, el bromo existe como sales de bromuro en lugar de BR2.

Figura 01: Bromo
El bromo puede oxidar los aniones de los elementos ubicados debajo del bromo en la tabla periódica. Sin embargo, no puede oxidar cloruro para dar cloro. Además, podemos producir BR tratando las salmueras ricas en bromuro con gas de cloro. O de lo contrario el gas de bromo se forma tratando HBR con ácido sulfúrico. El bromo es muy útil en los laboratorios de la industria y los químicos. Los compuestos de bromuro son importantes como aditivos de gasolina, para pesticidas y como desinfectante en la purificación del agua.
Que es el bromuro?
El bromuro es el anión que se forma cuando el bromo abstrae un electrón de otro elemento electropositivo. Podemos representarlo por el símbolo BR-. Es un ion monovalente con -1 carga. Por lo tanto, tiene 36 electrones y 35 protones.

La configuración electrónica del bromuro es [ar] 4s2 3D10 4p6. Existe en compuestos iónicos como bromuro de sodio, bromuro de calcio y HBR. También existe naturalmente en fuentes de agua.
¿Cuál es la diferencia entre bromo y bromuro??
El bromo es un elemento químico en la tabla periódica que se denota por BR, mientras que el bromuro es el anión que se forma cuando el bromo abstrae un electrón de otro elemento electropositivo. Además, la diferencia clave entre el bromo y el bromuro es que el bromuro es la forma reducida de bromo. Además, el bromuro tiene 36 electrones en comparación con 35 electrones de bromo, pero ambos tienen 35 protones. Por lo tanto, el bromuro tiene una carga de -1, mientras que el bromo es neutral.
Además, el bromo es más químicamente reactivo que el bromuro. Además, una mayor diferencia entre el bromo y el bromuro es que el bromuro ha logrado la configuración de electrones de Krypton y, por lo tanto, es más estable que el átomo de bromo.
Resumen -Bromo vs bromuro
El bromo es un elemento químico en la tabla periódica y se denota por BR. Mientras tanto, el bromuro es el anión que se forma cuando el bromo abstra un electrón de otro elemento electropositivo. Además, la diferencia clave entre el bromo y el bromuro es que el bromuro es la forma reducida de bromo.
Imagen de cortesía:
1. "Bromo 25 ml (transparente)" por W. Oelen -(CC BY -SA 3.0) a través de Commons Wikimedia
2. "Br-" por Neurotiker - Trabajo propio (dominio público) a través de Commons Wikimedia


