Diferencia entre la calcinación y la pirólisis
El diferencia clave entre la calcinación y la pirólisis es que La calcinación se realiza en presencia de una cantidad limitada de aire u oxígeno, mientras que la pirólisis se realiza en ausencia de aire.
La calcinación y la pirólisis son dos formas de reacciones de combustión que son diferentes entre sí de acuerdo con la cantidad de aire que está presente en la mezcla de reacción durante la reacción de combustión. La calcinación es un proceso químico en la pirometalurgia que implica el calentamiento del mineral de metal en presencia de aire u oxígeno limitado. La pirólisis, por otro lado, es una reacción de descomposición en la química donde los materiales orgánicos se descomponen en ausencia de oxígeno.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es la calcinación
3. ¿Qué es la pirólisis?
4. Comparación de lado a lado: calcinación y pirólisis en forma tabular
5. Resumen
Que es la calcinación
La calcinación es un proceso químico en la pirometalurgia que implica el calentamiento del mineral de metal en presencia de aire u oxígeno limitado. En el proceso de calcinación, necesitamos calentar el mineral a una temperatura por debajo de su punto de fusión. Este es un proceso muy útil. El nombre de calcinación proviene de un nombre latino debido a su aplicación principal: el calentamiento de los minerales de carbonato de calcio.
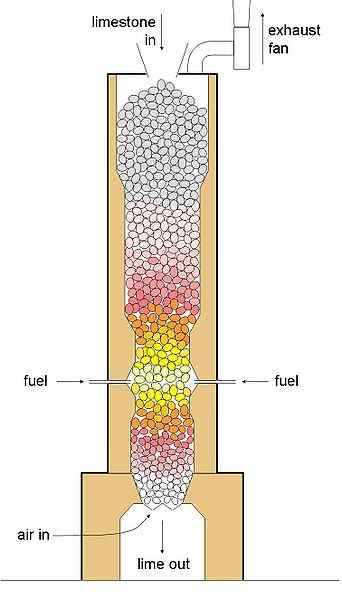
Figura 01: Calcinación
Podemos hacer el proceso de calcinación en un reactor que tiene una estructura cilíndrica; Lo llamamos el calcinero. La calcinación ocurre dentro de este reactor de calciner en condiciones controladas. El dióxido de carbono se forma y se libera durante la calcinación, y el carbonato de calcio se convierte en óxido de calcio. Este proceso de calcinación es importante, principalmente para eliminar las impurezas volátiles. Sin embargo, a veces necesitamos usar un horno para la calcinación porque implica calentar una sustancia a temperaturas muy altas.
Un buen ejemplo de calcinación es la producción de cal desde la piedra caliza. Durante este proceso, necesitamos calentar la piedra caliza a una temperatura alta, yo.mi., una temperatura lo suficientemente alta como para formar y liberar gas de dióxido de carbono. En este proceso, la cal se forma en una condición fácil de polvo.
¿Qué es la pirólisis??
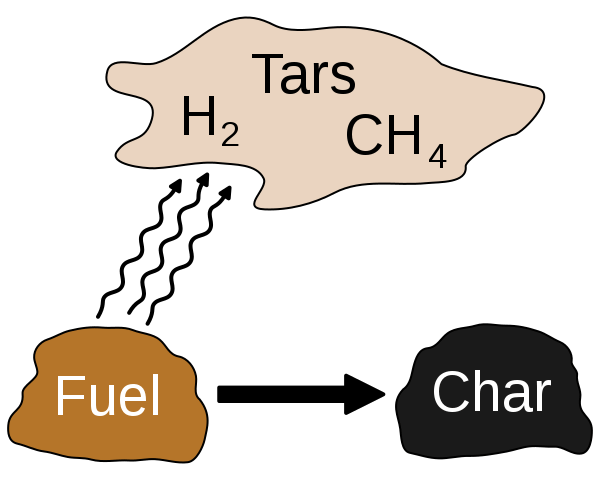
La pirólisis es una reacción de descomposición en la química donde los materiales orgánicos se descomponen en ausencia de oxígeno. Necesitamos aplicar calor para esta reacción al progreso. Por lo tanto, podemos aumentar la velocidad de reacción al aumentar la cantidad de calor proporcionado. En general, la pirólisis tiene lugar a los 430 o másOC. Sin embargo, la mayoría de las veces, podemos realizar estas reacciones en la ausencia cercana de oxígeno porque es muy difícil obtener una atmósfera libre de oxígeno. El producto final de esta reacción está en la fase gaseosa, la fase líquida o la fase sólida. Principalmente, este proceso produce gases. Si produce un líquido, llamamos a este líquido "alquitrán". Si es un sólido, por lo general, puede ser carbón o biochar.

Figura 02: pirólisis
La mayoría de las veces, la pirólisis convierte la materia orgánica en sus componentes gaseosos, un residuo sólido de carbono y cenizas, y un líquido llamado aceite pirolítico. Utilizamos dos métodos principales para eliminar cualquier contaminante de una sustancia; destrucción y eliminación. El proceso de destrucción desglosa los contaminantes en pequeños compuestos mientras el proceso de eliminación separa los contaminantes de la sustancia deseada.
Esta reacción se usa en diversas industrias para producir carbón, carbono activado, metanol, etc. Además, puede destruir compuestos orgánicos semivolátiles, combustibles, etc. Además, podemos usar este proceso para tratar los desechos orgánicos que salen de las fábricas.
¿Cuál es la diferencia entre la calcinación y la pirólisis??
La calcinación y la pirólisis son reacciones químicas importantes. La diferencia clave entre la calcinación y la pirólisis es que la calcinación se realiza en presencia de una cantidad limitada de aire u oxígeno, mientras que la pirólisis se realiza en ausencia de aire. La calcinación se usa en la producción de cal desde la piedra caliza, mientras que la pirólisis se usa en la producción de carbón, carbono activado, metanol, etc.
Debajo de la infografía resume las diferencias entre la calcinación y la pirólisis.
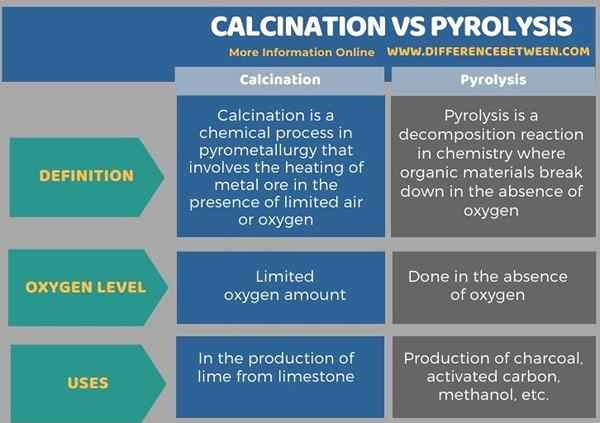
Resumen -Calcinación vs pirólisis
La calcinación y la pirólisis son reacciones químicas importantes. La diferencia clave entre la calcinación y la pirólisis es que la calcinación se realiza en presencia de una cantidad limitada de aire u oxígeno, mientras que la pirólisis se realiza en ausencia de aire.
Referencia:
1. Helmenstine, Anne Marie. “Definición de tostado en química."Thinkco, febrero. 11, 2020, disponible aquí.
Imagen de cortesía:
1. "Ldlimeshaftkilnbasic" de LinguisticDemographer - Originalmente de EN.Wikipedia. (Dominio público) a través de Commons Wikimedia
2. "Pirólisis" de Mintrick en English Wikipedia (CC BY-SA 3.0) a través de Commons Wikimedia


