Diferencia entre el carbono 12 y el carbono 14
El diferencia clave entre el carbono 12 y el carbono 14 es que El carbono 12 tiene 6 neutrones en su núcleo atómico, mientras que el carbono 14 tiene 8 neutrones.
El carbono 12 y el carbono 14 son isótopos del átomo de carbono. El átomo de carbono siempre tiene 6 protones. Por lo general, también tiene 6 neutrones, por lo que lo llamamos Carbon 12. Pero a veces hay 8 neutrones en lugar de 6, que es cuando se convierte en carbono 14. En reacciones químicas, el carbono 12 y el carbono 14 se comportan de manera similar. En general, el carbono se encuentra en el estado C 12, pero ocasionalmente también está disponible como C 14.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el carbono 12?
3. ¿Qué es el carbono 14?
4. Comparación de lado a lado - Carbon 12 vs Carbon 14 en forma tabular
5. Resumen
¿Qué es el carbono 12??
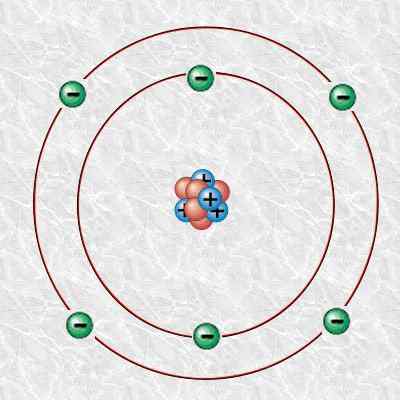
El carbono 12 es el isótopo de carbono natural más común, de la masa 12. Es la base de la escala aceptada de unidades de masa atómica. La abundancia de este carbono es de alrededor del 99%.

Figura 1: átomo de carbono
Además, este átomo de carbono consta de 6 protones, 6 electrones y 6 neutrones. Podemos denotar científicamente el carbono 12 como 12c. Su masa isotópica es 12 u.
¿Qué es el carbono 14??
El carbono 14 es un isótopo común de carbono. Lo llamamos "radiocarbono" ya que es un isótopo de carbono radiactivo. El núcleo atómico de este átomo contiene 6 protones, 6 electrones y 8 neutrones. Su masa isotópica es 14 u. Además, el carbono 14 es muy raro, y su abundancia es de aproximadamente 1 parte por trillón.
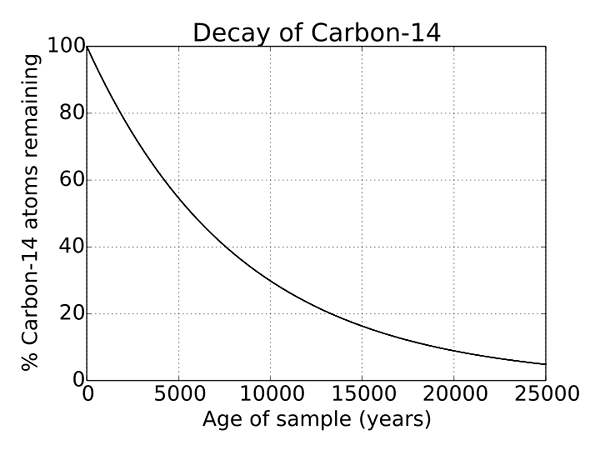
Figura 2: Decadencia radiactiva del carbono 14
Dado que C 14 es un isótopo inestable del átomo de carbono, sufre decadencia radiactiva. Y este es un proceso que ocurre para cada isótopo inestable y es un proceso natural. Es una propiedad única de C 14 y se usa para la determinación de objetos que tienen miles de años y se usa ampliamente en arqueología. La vida media de C 14 es de 5730 años.
¿Cuál es la diferencia entre Carbon 12 y Carbon 14??
C 12 y C 14 son isótopos del átomo de carbono. La diferencia clave entre el carbono 12 y el carbono 14 es que el carbono 12 tiene 6 neutrones en su núcleo atómico, mientras que el carbono 14 tiene 8 neutrones. Dado que el peso de protones y neutrones es el mismo, con 8 neutrones, C 14 es un 20% más pesado que C 12. Además, dado que tanto C 12 como C 14 tienen el mismo número de protones, su número atómico es el mismo, pero sus pesos atómicos son diferentes debido a la diferente número de neutrones. Entonces, esta es una diferencia significativa entre C 12 y C 14.
Además, C 12 y C 14 también se comportan de manera diferente cuando se trata de reacciones nucleares. Además, una mayor diferencia entre C 12 y C 14 es que C 12 se encuentra abundantemente en la corteza terrestre, mientras que C 14 es raro. Además, C 12 es un isótopo estable de carbono, mientras que C 14 es un isótopo inestable del átomo de carbono y sufre decadencia radiactiva.

Resumen -Carbono 12 vs Carbon 14
El carbono 12 y el carbono 14 son isótopos del átomo de carbono. El átomo de carbono siempre tiene 6 protones, pero el número de neutrones puede variar. Por ejemplo, el carbono 12 y el carbono 14 son diferentes isótopos de carbono que tienen diferentes números de neutrones. Por lo tanto, la diferencia clave entre el carbono 12 y el carbono 14 es que el carbono 12 tiene 6 neutrones en su núcleo atómico, mientras que el carbono 14 tiene 8 neutrones.
Referencia:
1. "Carbón."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7 de febrero. 2019, disponible aquí.
Imagen de cortesía:
1. "Atom de carbono" de Alejandro Porto-Trabajo propio (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Decadencia radiactiva de carbono-14 SVG" por ExeterPaul-Trabajo propio (CC BY-SA 3.0) a través de Commons Wikimedia


