Diferencia entre carbono y diamante
El diferencia clave entre el carbono y el diamante es que El carbono es un elemento químico, mientras que el diamante es una alotrape de carbono.
El carbono es un elemento químico que tiene el número 6 atómico y el símbolo químico C. Ocurre en la naturaleza en diferentes estructuras, que llamamos alotropas de carbono. Estas estructuras contienen solo carbono como elemento químico, pero la disposición espacial de los átomos de carbono es diferente entre sí. Diamond también es un tipo de alotropas. Las propiedades físicas de las alotropas son diferentes entre sí también.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es el carbono
3. Que es el diamante
4. Comparación de lado a lado - Carbon vs Diamond en forma tabular
5. Resumen
Que es el carbono?
El carbono es un elemento químico que tiene el número 6 atómico y el símbolo químico C. Es un no metal ubicado como elemento de bloque P en la tabla periódica de elementos. Según la configuración electrónica de carbono ([él] 2s2 2P2), un átomo de carbono puede formar cuatro enlaces químicos covalentes. Además, este elemento tiene isótopos (átomos del mismo elemento que tiene diferentes números de neutrones). El isótopo de carbono más abundante y estable es de 12 ° C, mientras que 13C es un isótopo estable pero menos abundante; 14C, por otro lado, es un isótopo radiactivo.
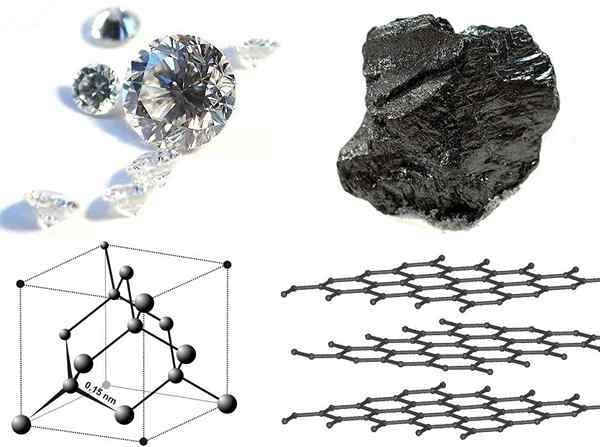
Figura 01: alotropas de carbono
Las alotropas de carbono son las diferentes formas estructurales de carbono que solo tienen átomos de carbono pero diferentes arreglos espaciales. Estas son las formas de carbono naturales que ocurren. Los ejemplos más comunes son el diamante y el grafito. Aunque ambas estructuras consisten solo en átomos de carbono, tienen diferentes propiedades físicas debido a las diferencias en la disposición espacial. Por ejemplo, el diamante es transparente, mientras que el grafito es opaco. Además, algunos otros hechos químicos sobre el carbono se enumeran de la siguiente manera:
- El número atómico es 6
- El número de masa es 12.011
- Grupo 14 y período 2
- elemento de bloque P
- Reactivo Non Metal
- A temperatura y presión estándar, ocurre en estado sólido
- El punto de sublimación es 3642 ° C
- Triple Point es 4600 K, 10,800 kPa
- El estado de oxidación más común es +4
Que es el diamante?
Diamond es una alotrape de carbono. Es una forma sólida de carbono que tiene una forma tridimensional. Además, cada átomo de carbono se une con otros cuatro átomos de carbono a través de un enlace químico covalente. Y, esta estructura cristalina se llama estructura "diamante cúbica". Además, entre todos los materiales naturales, este compuesto tiene la mayor dureza y conductividad térmica. Por lo tanto, el diamante es común en las industrias para las herramientas de corte y pulido.

Figura 02: Diamante vs grafito
Algunos hechos importantes sobre el diamante son los siguientes:
- Cae a la categoría de minerales nativos
- La unidad de repetición es carbono
- La masa de fórmula es 12.01 g/mol
- El color es típicamente amarillo, marrón o gris a incoloro
- La fractura es irregular/desigual
- Además, su racha mineral es incolora
¿Cuál es la diferencia entre el carbono y el diamante??
El carbono es un elemento químico que tiene un número 6 atómico y el símbolo químico C, mientras que el diamante es la alotrape más fuerte del carbono. La diferencia clave entre el carbono y el diamante es que el carbono es un elemento químico, mientras que el diamante es una alotrape de carbono. Además, la apariencia de carbono depende del tipo de alotropas, e.G Grafito tiene un color oscuro y es opaco, mientras que el diamante es transparente y aparece típicamente amarillo, marrón o gris a incoloro. Aunque la mayoría de las alotropas de carbono tienen una menor resistencia, el diamante es los materiales más fuertes que ocurren naturalmente en la Tierra.
La siguiente tabla presenta la diferencia entre el carbono y el diamante.

Resumen -Carbono vs Diamante
El carbono tiene muchos alotropas comunes, mientras que la estructura más fuerte entre ellos es el diamante. Por lo tanto, la diferencia clave entre el carbono y el diamante es que el carbono es un elemento químico, mientras que el diamante es una alotrape de carbono.
Referencia:
1. "Carbón."Wikipedia, Fundación Wikimedia, 26 de abril. 2019, disponible aquí.
2. "Diamante."Geología.com, disponible aquí.
Imagen de cortesía:
1. "Ocho alotropas de carbono" por Michael Ströck (Mstroeck) - (CC BY -SA 3.0) a través de Commons Wikimedia
2. "Diamond y Graphite2" de Diamond_and_Graphite.JPG: Usuario: Itubderivative Work: MaterialScientist (Talk) - Diamond_and_Graphite.JPGFILE: Graphite-TN19A.JPG (CC BY-SA 3.0) a través de Commons Wikimedia


