Diferencia entre carbonato y bicarbonato
El diferencia clave entre carbonato y bicarbonato es que El ion de carbonato tiene -2 carga eléctrica, mientras que el bicarbonato tiene -1 carga eléctrica.
El cuerpo humano produce dióxido de carbono como un subproducto del metabolismo. La mayor parte de este dióxido de carbono se disuelve en el plasma sanguíneo y presente en forma de bicarbonato. El sistema de carbonato y bicarbonato es el principal responsable de mantener nuestro valor de pH de sangre, y actúan como un amortiguación en nuestra sangre. Cuando el dióxido de carbono se disuelve en agua, se forma bicarbonato y ácido carbónico, y existe un equilibrio entre estas especies.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es carbonato
3. ¿Qué es el bicarbonato?
4. Comparación lado a lado: carbonato vs bicarbonato en forma tabular
5. Resumen
Que es carbonato?
El carbonato es un ion inorgánico que contiene un átomo de carbono y tres átomos de oxígeno. Tiene una carga divalente negativa (-2 carga eléctrica). El ion de carbonato tiene una geometría plana trigonal, y su peso molecular es de 60 g de moles-1.
Aunque la estructura de Lewis del ion de carbonato tiene un doble enlace de oxígeno de carbono y dos enlaces únicos de oxígeno de carbono, no es la estructura real. El ion de carbonato muestra la estabilización de resonancia. Por lo tanto, tiene una estructura híbrida de todas las estructuras de resonancia. Por lo tanto, todos los enlaces de oxígeno de carbono tienen una longitud similar, y los átomos de oxígeno tienen una carga negativa parcial (por lo tanto, todos los átomos de oxígeno son similares.).
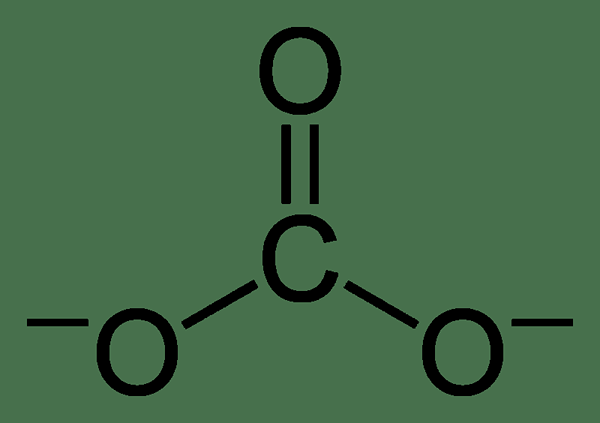
Figura 01: Estructura química del ion de carbonato
Cuando el dióxido de carbono o el bicarbonato se disuelve en agua, se forman los iones de carbonato. Y, este ion está en equilibrio con iones de bicarbonato. Naturalmente, se combina con otro ion metálico u otro ion positivo para hacer compuestos. Existen varios tipos de rocas de carbonato, como piedra caliza (carbonato de calcio), dolomita (carbonato de calcio-magnesio), potasa (carbonato de potasio), etc.
Además, los compuestos de carbonato juegan un papel crucial en el ciclo del carbono. Con el tiempo, los compuestos que contienen carbono se convierten en rocas sedimentarias cuando se depositan durante mucho tiempo. Luego, cuando estas rocas se meteorizan, el dióxido de carbono se devuelve a la atmósfera. Del mismo modo, al calentar estos compuestos, liberan dióxido de carbono fácilmente. Además, los compuestos de carbonato son iónicos, y son insolubles en agua.
¿Qué es el bicarbonato??
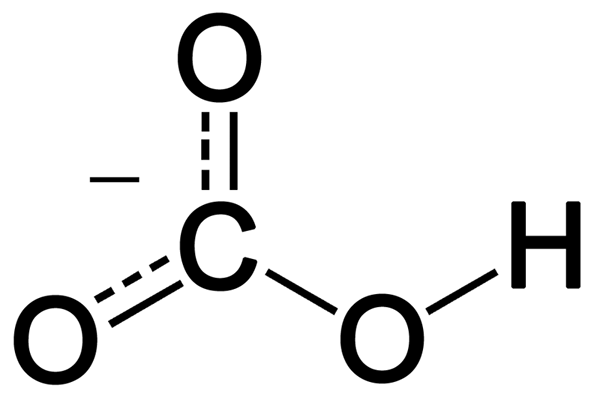
El bicarbonato es un anión monovalente que tiene un hidrógeno, uno de carbono y tres átomos de oxígeno. Se forma a partir de la desprotonación del ácido carbónico. Tiene geometría plana trigonal alrededor del átomo de carbono central. El ion bicarbonato tiene un peso molecular de 61 g de mol-1.

Figura 02: Estructura de resonancia del ion bicarbonato
Además, este ion muestra la estabilización de resonancia entre los dos átomos de oxígeno, que no están conectados al hidrógeno. En la naturaleza, el bicarbonato es alcalino, y es el ácido conjugado del ion de carbonato y la base conjugada del ácido carbónico. Además, los iones cargados positivamente pueden combinarse con el oxígeno cargado negativamente en este ion y formar sales iónicas. La sal más común de bicarbonato es el bicarbonato de sodio, que nombramos como polvo de hornear en el uso diario. Además, los compuestos de bicarbonato liberan dióxido de carbono al reaccionar con ácidos.
¿Cuál es la diferencia entre carbonato y bicarbonato??
El carbonato y el bicarbonato son aniones inorgánicos. La diferencia clave entre el carbonato y el bicarbonato es que el ion de carbonato tiene -2 carga eléctrica, mientras que el bicarbonato tiene -1 carga eléctrica. Además, debido a la presencia del átomo de hidrógeno, la masa molar de iones de carbonato es de 60 g/mol, mientras que la masa molar de iones de bicarbonato es de 61 g/mol.
Otra diferencia significativa entre carbonato y bicarbonato es que, en condiciones muy básicas, habrá más iones de carbonato, mientras que los iones de bicarbonato estarán más en una solución básica débil. Además, la capacidad de disolverse en agua también contribuye a una diferencia entre el carbonato y el bicarbonato. Eso es; Los compuestos con iones de carbonato no son solubles en agua a temperatura ambiente y presión atmosférica. Sin embargo, muchas sales de bicarbonato son solubles en agua a temperatura ambiente.
A continuación se muestra un resumen de la diferencia entre carbonato y bicarbonato en forma tabular.
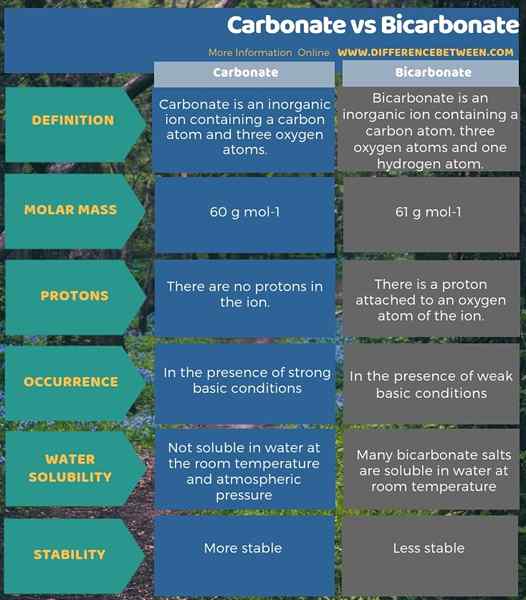
Resumen -carbonato vs bicarbonato
Tanto el carbonato como el bicarbonato son iones que contienen átomos de carbono y oxígeno. Sin embargo, el ion bicarbonato también tiene un átomo de hidrógeno. Por lo tanto, este átomo de hidrógeno hace que el ion se convierta en aniones monovalentes, mientras que el carbonato es un anión divalente. En resumen, la diferencia clave entre carbonato y bicarbonato es que el ion de carbonato tiene -2 carga eléctrica, mientras que el bicarbonato tiene -1 carga eléctrica.
Referencia:
1. Britannica, los editores de Encyclopedia. "Carbonato."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 20 de julio de 1998. Disponible aquí
2. "Ion de bicarbonato."Centro Nacional de Información de Biotecnología. Base de datos de compuestos de pubChem, u.S. Biblioteca Nacional de Medicina. Disponible aquí
Imagen de cortesía:
1."Localizado de carbonato-ion-2D" por Ben Mills-Trabajo propio, (dominio público) a través de Commons Wikimedia
2."Resonancia de bicarbonato" de Hellbus-Trabajo propio, (CC By-Sa 3.0) a través de Commons Wikimedia


